Постойте! Лиганд, который связывался с p75NTR, полностью деактивировал суицидальный механизм, т. е. вытаскивал клетку из петли. Таким образом, мы обнаружили совершенно новый тип рецептора, который, будучи в покое (ожидая привязки к лиганду), являлся виновником клеточной смерти, но после связи с лигандом начинал ее предотвращать. Это то же самое, что обнаружить новый тип замка, который бы сжигал дом дотла после извлечения ключа (лиганда) из скважины. По сути, когда клетка вырабатывает такой рецептор, она подсаживается на «лигандную» иглу. Ключ всегда доложен оставаться в замке, иначе… Наличие подобного рецептора ставит нейрон на грань между жизнью и смертью. Синтезируя его, нейрон впадает в зависимость от нейротрофина: без нейротрофинового ключа он погибает. В результате мы окрестили эти рецепторы рецепторами зависимости и опубликовали результаты в популярном журнале Science («Наука»)(1).
Наступил сезон отпусков, но я не мог думать ни о чем, кроме новых рецепторов, которые не укладывались в рамки знаний, приобретенных мной в университете. Поведенческий профиль наводил на мысль об их возможном участии в развитии эмбрионов, онкологических и нейродегенеративных заболеваний. Это предположение подтвердилось и позволило нам сделать еще один шаг к разгадке болезни Альцгеймера. Неужели именно рецепторы зависимости, потерявшие свои лиганды, провоцировали гибель мозговых клеток?
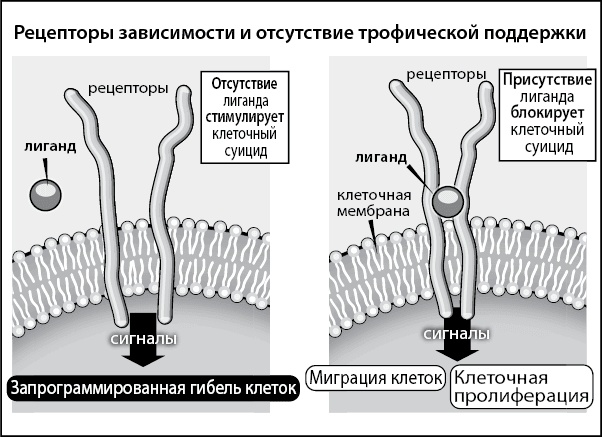
Рис. 1. Рецепторы зависимости стимулируют гибель клеток, когда они не связаны с лигандами, однако этот процесс «выключается», когда лиганд взаимодействует с рецептором зависимости.
Сила каждой новой теории кроется в точности предположений, ее красоте, простоте и масштабах применения. Что касается теории рецепторов зависимости, она точно предсказывает молекулярные изменения в процессе распространения раковых клеток, предлагает инновационный метод лечения метастазов – самых серьезных осложнений – и, как вы увидите далее, ведет нас к созданию эффективной терапии болезни Альцгеймера. Ее простота позволяет интерпретировать сложные процессы развития, образования опухолей, метастазирования, старения, нейродегенерации, поэтому ее применение многогранно и широкомасштабно.
На сегодняшний день идентифицирован двадцать один рецептор зависимости, проведено семь международных конференций, опубликовано более сотни научных статей. Как оказалось, эти рецепторы контролируют зависимость от разного рода молекул: от трофических факторов и гормонов до связывающих молекул, которые укрепляют положение клеток. Они регулируют некоторые аспекты развития эмбриона, соединение вводных данных с мишенью в нервной системе и устранение клеток, оказавшихся без должной поддержки. Однако нам хотелось знать, есть ли связь между этими рецепторами и болезнью Альцгеймера. Если да, то каким образом сложить осколки информации – а это более 50 000 научных статей, посвященных болезни Альцгеймера, вместе?
[12]
Учась в колледже, я прочитал об одной удивительной вещи. В 1928 году Пол Дирак, который в 1933 году станет лауреатом Нобелевской премии по физике, задался вопросом: существует ли нечто похожее на электронную «дырку», т. е. своего рода противоположность электрону. Предсказанная им частица – антиэлектрон, или позитрон – была открыта пару лет спустя, в 1932 году, подтвердив существование антивещества. Обнаруженные нами рецепторы зависимости говорили своим нейронам «Умри!», когда лишались молекул нейротрофина. Таким образом, нейротрофины давали жизнь и предотвращали гибель. Нам стало интересно, а существует ли антитрофин? Теоретически такая молекула могла блокировать нейротрофины и мешать им связываться с рецепторами зависимости, например заняв их место. (Вернемся к нашему сравнению: фура не сможет въехать в терминал зоны погрузки, если там уже стоит другая). То есть пока антитрофин не пускал нейротрофин, рецепторы посылали нейронам сигнал «Умри!», как если бы нейротрофина не было вовсе. С удивлением мы узнали, что именно это и происходит при развитии болезни Альцгеймера.
Что такое болезнь Альцгеймера на самом деле
Как установил сам доктор Алоис Альцгеймер, в мозге человека, страдающего заболеванием, которое сегодня носит его имя, образуются бляшки и клубки. Бляшки, которые по виду напоминают колючие плоды амбрового дерева, преимущественно состоят из пептида бета-амилоида (Aβ). (Об этом я подробно рассказал в главе 1).
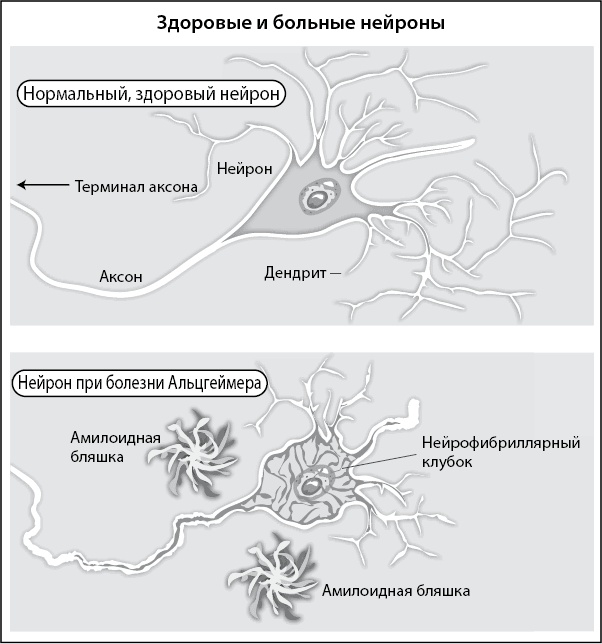
Рис. 2. При болезни Альцгеймера в головном мозге человека образуются амилоидные бляшки и нейрофибриллярные клубки.
Нормальная функция бета-амилоида не дает покоя неврологам, и все же получается, что бета-амилоид токсичен для нейронов, особенно если он образует группировки, т. е. олигомеры. Как оказалось, бета-амилоид подходит под все критерии антитрофина: он связывается с различными рецепторами на поверхности нейрона и блокирует трофические сигналы, запрещающие рецепторам зависимости говорить нейронам: «Умри!»
Трофическое блокирование не всегда является признаком отклонения. Как я уже говорил, в некоторых случаях клетки должны погибать, например при наличии повреждений или других факторов, мешающих им выполнять свою функцию, т. е. уйти с дороги и дать дорогу молодым. Однако избыток трофического блокирования ведет к тому, что слишком много рецепторов зависимости толкают свои нейроны на смерть.
Реальная картина болезни Альцгеймера постепенно начинает проявляться. Молекула бета-амилоид, которая выступает в роли антитрофина, накапливается в головном мозге, провоцируя рецепторы зависимости сокращать число соединений (отвечающих за память синапсов, которые утрачиваются при болезни Альцгеймера) и в конечном итоге убивать нейроны. Но что вызывает переизбыток бета-амилоида?

Гормоны щитовидной железы, инсулин, «молекула долголетия», содержащаяся в красном вине, витамины, сон, стресс и многое другое… Эти факторы кажутся довольно разнородными, однако все они могут запустить или остановить болезнь Альцгеймера.
Чтобы разобраться, нам нужно вернуться к истокам бета-амилоида, т. е. к молекуле, в состав которой он входит. Эта молекула носит говорящее название – предшественник бета-амилоида (APP). В 2000 году мы узнали, что APP является рецептором зависимости и, как все ему подобные, располагается на поверхности нейронов
[13] рядом с синапсами. APP – довольно большой рецептор: он состоит из 695 похожих на бусинки аминокислот. (Бета-амилоид – это только кусок APP, состоящий из 40-42 аминокислот). То, как APP функционирует в роли рецептора зависимости, позволяет нам понять первопричину болезни Альцгеймера.





