Загадка кроется в различии путей бифуркации электронов у метаногенов и ацетогенов. Хотя и те, и другие используют весьма сходные железо-никелево-серные белки, многие другие белки и детали механизма бифуркации электронов у них различаются. Как и метаногены, ацетогены запасают энергию, выделяющуюся при реакции H2 с CO2, в форме градиента H+ или Na+ на мембране. В обоих случаях этот градиент расходуется на поддержание углеродного и энергетического метаболизма. И у метаногенов, у ацетогенов есть АТФ-синтаза и энергопреобразующая гидрогеназа, но, в отличие от метаногенов, ацетогены не используют энергопреобразующую гидрогеназу для непосредственного поддержания углеродного метаболизма. Напротив, у некоторых ацетогенов энергопреобразующая гидрогеназа работает в обратном направлении. Ацетогены и метаногены сильно различаются в деталях углеродного метаболизма, и эти детали кажутся настолько фундаментальными, что некоторые специалисты утверждают даже, что сходство метаногенов и ацетогенов есть следствие конвергентной эволюции или горизонтального переноса генов, а не происхождения от общего предка.
Сходство и различия метаногенов и ацетогенов складываются в единую картину, если допустить, что Последний всеобщий предок зависел от природных протонных градиентов. В этом случае ключ к пониманию различий в механизмах создания мембранных градиентов у метаногенов и ацетогенов – это направление естественного потока протонов через энергопреобразующую гидрогеназу. Был ли он направлен внутрь клетки и осуществлял фиксацию углерода – или был обращен наружу через белок, который сейчас функционирует как мембранный насос, выкачивающий из клетки протоны (рис. 20)? Думаю, что поток протонов в предковой популяции протоклеток был направлен вовнутрь, и его энергия расходовалась на фиксацию CO2. Затем две отдельные популяции независимо приобрели механизмы создания протонных градиентов. В популяции, от которой произошли ацетогены, произошло обращение работы энергопреобразующей гидрогеназы: она стала окислять ферредоксин и за счет выделившейся энергии выкачивать протоны из клетки. Но это простое и полезное приобретение порождает проблему: восстановленный ферредоксин, который ранее использовался для фиксации углерода, теперь расходуется на транспорт протонов. Поэтому ацетогенам прошлось изобрести новый способ восстановления углерода, который не зависит от ферредоксина. Их предки нашли хитроумный выход: бифуркация потока электронов, которая позволяет осуществлять непрямое восстановление CO2. Вполне возможно, что происхождение базовой биохимии ацетогенов вытекает из этого простого допущения – инверсии работы энергопреобразующей гидрогеназы, в результате чего ацетогены приобрели протонный насос, а с этим и ряд проблем, которые им пришлось решить.
В другой популяции клеток, давшей начало метаногенам, был найден альтернативный путь создания ионных градиентов. Клетки в этой популяции, как и их предшественники, восстанавливали ферредоксин, используя энергию протонных градиентов, и при помощи восстановленного ферредоксина осуществляли фиксацию углерода. Но этим клеткам пришлось с нуля изобрести ионный насос. Ну, почти с нуля: они переоборудовали для этой цели другой белок. Вероятнее всего, они превратили свой антипортер в прямой насос. Осуществить это несложно, но возникла проблема: как снабдить насос энергией? Метаногены приобрели другой тип бифуркации электронов. Они пользовались для этого теми же белками, что и ацетогены, но сообразно своим потребностям построили совершенно иной путь, позволяющий подключить ионный насос. Различия в углеродном и энергетическом метаболизме у метаногенов и ацетогенов связаны с направлением потока протонов через энергопреобразующую гидрогеназу. Можно выбрать: либо внутрь, либо наружу. Метаногены и ацетогены выбрали разные решения.
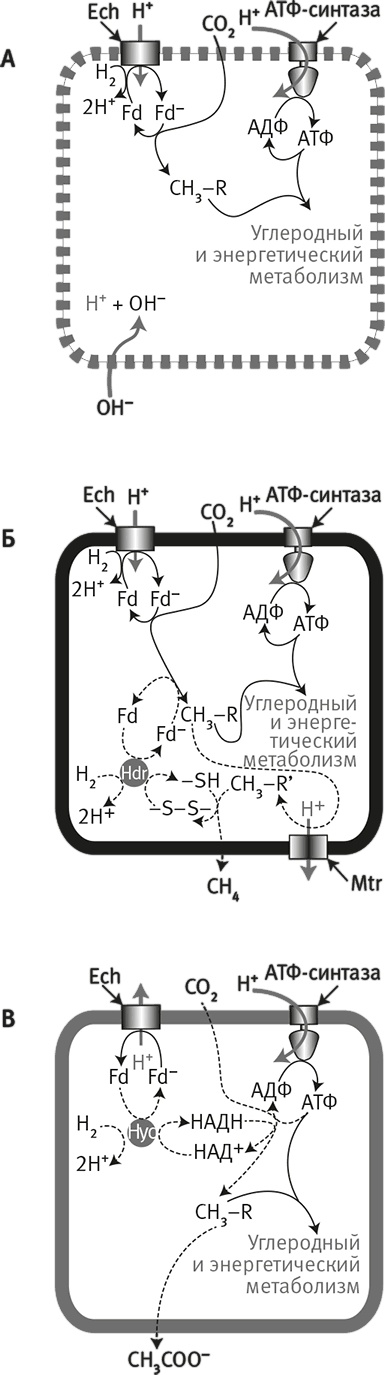
Рис. 20. Модель эволюции активного транспорта ионов.
Гипотеза происхождения активного транспорта ионов у бактерий и архей, основанная на направлении потока протонов через мембранный белок Ech.
А. В предковом состоянии естественный протонный градиент поддерживает углеродный и энергетический метаболизм посредством энергопреобразующей гидрогеназы (Ech) и АТФ-синтазы. Это путь возможен лишь до тех пор, пока мембрана “проницаема” для протонов.
Б. Клетки метаногенов (предположительно, именно такой образ жизни вели предки архей) также используют Ech и АТФ-синтазу для углеродного и энергетического метаболизма. Однако непроницаемые для протонов мембраны уже не позволяют им использовать естественные протонные градиенты. Поэтому им пришлось найти новые биохимические пути (пунктирные линии) и изобрести новый ионный насос (метилтрансферазу, Mtr) для получения собственных H+– или Na+-градиентов. (Обратите внимание: эта схема получается в результате комбинации схем А и Б на рис. 18.)
В. Ацетогены (предположительно древнейшая ветвь бактерий). Ech стала работать в обратном направлении, выкачивая протоны из клетки за счет энергии окисления восстановленного ферредоксина. Поэтому ацетогенам не потребовалось изобретать новый ионный насос, но пришлось найти новый путь фиксации CO2 – с использованием НАДН и АТФ (пунктирные линии). Этот гипотетический сценарий позволяет объяснить все сходства и различия пути Вуда – Льюнгдаля у метаногенов и ацетогенов.
Когда обе группы клеток тем или иным способом приобрели механизмы активного транспорта ионов, им наконец стало выгодным усовершенствование мембран. На ранних этапах развития мембраны современного типа, обогащенные фосфолипидами, не приносили никакой пользы и даже были бы вредны. Но вскоре после того, как клетки приобрели антипортер и ионные насосы, стало выгодным встраивать в мембраны липиды с глицерольными полярными группами. Такие липиды, по-видимому, независимо появились в двух разных доменах, поэтому археи и бактерии в мембранных липидах используют зеркальные стереоизомеры глицерола (гл. 2).
Теперь, когда клетки приобрели активный транспорт ионов и мембраны современного типа, они смогли покинуть гидротермальные источники и выйти в океан. От общего предка, который жил за счет естественных протонных градиентов источников, отделились две ветви: археи и бактерии. Нет ничего удивительного ни в том, что бактерии и археи приобрели разные клеточные стенки, защищающие в незнакомой среде, ни в том, что они сконструировали различные механизмы репликации ДНК. У бактерий в ходе деления клетки ДНК прикрепляется к мембране за особый участок – репликон
[66], что позволяет дочерним клеткам получить по копии родительского генома. Структура задействованных в этом молекулярных комплексов, как и многих других компонентов репликации ДНК, должна хотя бы отчасти зависеть от механизма прикрепления ДНК к мембране. Независимое происхождение клеточных мембран позволяет объяснить различия в репликации ДНК у архей и бактерий. То же самое относится к строению клеточных стенок. Перед постройкой клеточной стенки необходимо транспортировать все предшественники наружу через специальные мембранные поры. То есть синтез клеточной стенки зависит от свойств мембран, а отсюда следует, что у архей и бактерий он должен различаться.



