Таким образом, три промежуточных соединения на пути между водой и кислородом образуют коварную циклическую систему, которая в присутствии железа повреждает биологические молекулы. Супероксидные радикалы высвобождают запасенное железо, переводя его в растворимую форму. Пероксид водорода взаимодействует с железом, образуя гидроксильные радикалы. Гидроксильные радикалы атакуют любые белки, жиры и ДНК, инициируя деструктивные цепные реакции, нарушающие функцию клеток.
Те же самые промежуточные соединения образуются из кислорода при дыхании. В начале 1950-х гг. на сходство между токсичностью кислорода и облучением обратила внимание Ребека Гершман, тогда работавшая в Университете Рочестера (в рамках Манхэттенского проекта там проводились исследования влияния радиации на биологические системы). На ее семинаре в 1953 г. этими данными заинтересовался молодой аспирант Даниел Гилберт, ранее изучавший физиологию мышечной ткани. Гершман и Гилберт предположили, что свободные радикалы кислорода ответственны за летальные повреждения организма при отравлении кислородом и при облучении. Их данные были опубликованы в знаменитой статье в журнале Science в 1954 г. под недвусмысленным заголовком «Отравление кислородом и ультрафиолетовое излучение — общность механизмов», который я использовал в названии данной главы. Проведенные с тех пор исследования подтверждают, что радиационные повреждения и кислородная интоксикация имеют между собой очень много общего.
Кислород — удивительный элемент. Теоретически кислород легче отбирает электроны у других молекул, чем вода отдает свои электроны. Вода — химически устойчивое вещество. Чтобы забрать у воды электроны, нужно затратить энергию, источником которой может быть ионизирующее или ультрафиолетовое излучение или солнечный свет (при фотосинтезе). Напротив, реакции с участием кислорода сопровождаются выделением энергии. Горение — реакция между кислородом и соединениями углерода, и выделяющееся в ходе этой реакции тепло свидетельствует о том, что реакция может протекать почти спонтанно. В энергетическом плане не важно, быстро ли сжигается топливо, как при горении, или медленно, как при дыхании. Вне зависимости от того, идет ли речь о метаболизме или горении, из 125 г сахара (столько его нужно для приготовления бисквитного пирога) образуется 1790 кДж (428 ккал) энергии — достаточно, чтобы вскипятить 3 л воды или поддерживать горение лампочки мощностью 100 Вт на протяжении 5 часов.
Тот факт, что при такой благоприятной энергетике и обилии кислорода в атмосфере все вокруг не возгорается самопроизвольно, указывает на непонятное нежелание кислорода вступать в химические реакции. Дело заключается в химических связях между атомами в молекуле кислорода. Химия кислорода сложна, но она объясняет не только образование свободных радикалов в человеческом организме, но и невозможность самопроизвольного возгорания. Давайте немного поговорим об этом. В 1891 г. великий шотландский химик сэр Джеймс Дьюар обнаружил у кислорода магнитные свойства. Это открытие было сделано в жестокой борьбе за получение жидкого кислорода. Соревнование выиграл француз Луи Кайете, который добыл несколько капель жидкого кислорода накануне Рождества 1877 г., едва опередив своего швейцарского соперника Рауля Пикте. Годом позже Дьюар демонстрировал изумленной публике получение жидкого кислорода во время одного из пятничных вечеров в Королевском институте. Дьюар был звездой на этих вечерах, которые традиционно проходили в знаменитой аудитории, где многие приглашенные совершенно терялись перед бьющим в зале «фонтаном красноречия». Но Дьюар был не только одаренным исполнителем, но и одним из лучших экспериментаторов того времени. К середине 1880-х гг. он усовершенствовал свой метод и смог получить достаточно жидкого кислорода, чтобы подробно изучить его свойства. Вскоре он обнаружил, что жидкий кислород (на самом деле озон, О3) притягивается к полюсам магнита. В 1891 г. на одном из пятничных вечеров Дьюар с присущим ему артистизмом демонстрировал аудитории свое открытие, используя сильный магнит и недавно созданный им вакуумный сосуд, который теперь во всех лабораториях мира называют сосудом Дьюара. Этот опыт стал классическим, его показывают студентам во многих университетах (вы можете найти его демонстрацию в Интернете). Жидкий кислород выходит из сосуда Дьюара, притягиваемый магнитом. Жидкость повисает в воздухе и налипает на магнит, образуя облако, которое прогибается между полюсами магнита, а затем испаряется.
Что же при этом происходит? В 1925 г. Роберт Малликен смог объяснить магнитные свойства кислорода, применив сформулированную незадолго до того квантовую теорию. Магнитные свойства вещества объясняются спином неспаренного электрона, а как показал Малликен, в молекуле кислорода есть два неспаренных электрона
[36]. Именно они определяют химические свойства этого элемента и усложняют получение молекулярным кислородом других электронов для образования химических связей (рис. 8). Из данного химического тупика есть два выхода. Во-первых, кислород может получить энергию от другой молекулы, возбужденной теплом или светом, что изменит спин одного из неспаренных электронов кислорода. Такое действие оказывают некоторые пигменты, что используется для фотодинамической терапии, основанной на способности активированного светом пигмента разрушать опухоли или другие патологические ткани.
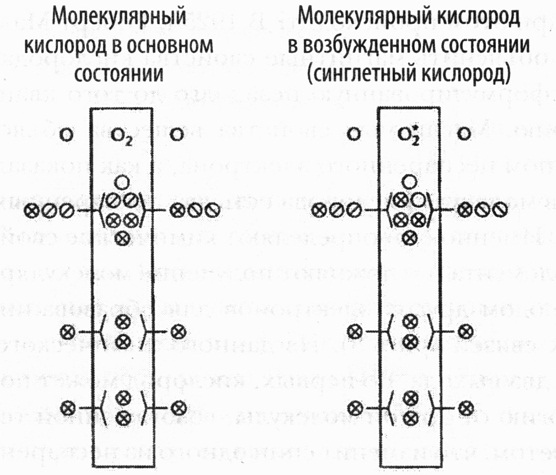
Рис 8. Заполнение электронных орбиталей в молекуле кислорода: (а) в основном состоянии («нормальный» кислород); (б) в возбужденном состоянии («синглетный» кислород). Крестиками обозначены пары электронов, а диагональными линиями ― единичные электроны. Кружки ― это электронные орбитали, пустые кружки ― незанятые орбитали. В соответствии с правилом Хунда сначала электроны по одному заполняют все орбитали с конкретным уровнем энергии (показаны на одном уровне), и лишь после заполнения всех свободных орбиталей образуются пары электронов. Вот почему атомарный кислород (показан сбоку в каждом случае) содержит два неспаренных электрона. При слиянии электронных орбиталей в ходе образования молекулы кислорода действует тот же самое правило, поэтому кислород в основном состоянии имеет два неспаренных электрона с параллельными спинами. Из-за этого кислород может принимать только по одному электрону с антипараллельным спинами, что приводит к образованию пар электронов. В синглетном кислороде один один из неспаренных электронов, нарушив правило Хунда, изменяет направление спина и спаривается со вторым электроном, освобождая орбиталь с низким уровнем энергии. Вот почему синглетный кислород очень реакционноспособен.



