Но – минуточку! Если лед (Н2О в твердом состоянии) плавает в воде (Н2О в жидком состоянии), получается, что плотность льда меньше плотности воды? Но это же неслыханно! Разве может жидкость быть плотнее твердого вещества? Вы, наверное, догадываетесь: все дело в водородных мостиках. Эту странность называют аномалией плотности воды.
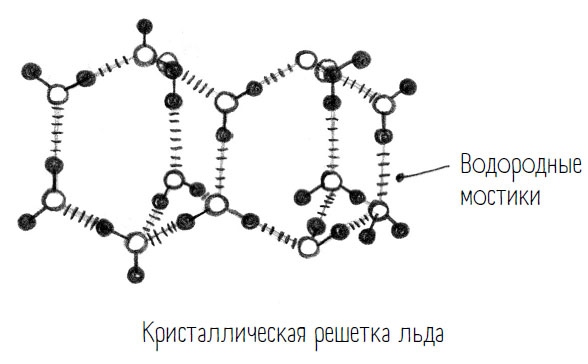
Когда воду охлаждают, поначалу она ведет себя совершенно нормально: температура падает – плотность повышается, как и положено. По мере того как частицы замедляют свое движение, создаются все лучшие условия для образования водородных мостиков, и эти мостики сводят частицы все ближе друг к другу. Однако при 4°С вода достигает своей максимально возможной плотности. После чего происходит странное: при дальнейшем понижении температуры до 0°С плотность снова уменьшается, то есть молекулы воды снова отодвигаются друг от друга.
Почему они это делают? А потому, что движение частиц становится таким медленным, что молекулы воды только в этот момент получают время и паузу на то, чтобы основательно сорганизоваться для образования кристаллической решетки льда.
Эту упорядоченную структуру можно почти невооруженным глазом наблюдать в снежинке или кристалле льда. Узор снежинки – это и есть результат симметричного построения атомов внутри нее. В кристалле льда каждый атом кислорода окружен четырьмя атомами водорода. С двумя из них он связан ковалентно, с двумя другими – водородными мостиками. В этой решетчатой структуре относительно большие полые зазоры и потому меньшая плотность.
И что же с этого рыбам в озере?
Когда зимой вода охлаждается, она опускается на дно, потому что чем она холоднее, тем плотнее (на разговорном языке «тяжелее»). Поскольку при 4 °C вода обретает свою максимальную плотность, на дне озера температура воды 4 °C, а выше она постепенно становится холоднее. В какой-то момент поверхность озера начинает замерзать, причем сверху вниз. Если бы не существовало аномалии плотности воды, лед был бы тяжелее воды, и озеро замерзало бы снизу вверх. Тогда снизу подступал бы лед, сверху добавлялся бы холодный зимний воздух, и озеро замерзало бы целиком – от самого дна и до поверхности. Поскольку же озера замерзают сверху вниз, слой льда действует как изолятор для нижерасположенных слоев воды, и у рыб зимой есть место где плавать в жидкой воде. И дышать.
У людей своя зимняя радость от аномалии плотности воды – без нее на коньках не очень-то покатаешься. Вообще-то, если призадуматься, катание на коньках – это еще один большой курьез. Ведь почему, собственно, кататься можно только на льду? Почему бы не прокатиться на коньках по любому другому твердому веществу – скажем, по асфальту? А потому, что на льду мы своими коньками твердого вещества вообще не касаемся! Мы скользим по тонкому слою воды, который образуется в тот момент, когда давим на лед полозьями коньков. Будь под коньками другие вещества, для достижения изменения агрегатного состояния от твердого к жидкому пришлось бы уменьшать давление. Но аномалия воды позволяет достичь смены агрегатного состояния иначе: из-за повышения давления частицы сдавливаются плотнее; стремясь потесниться, они теряют свою крупноячеистую кристаллическую решетку, и образуется жидкий слой, по которому можно легко скользить. И получается, что если бы муравей захотел покататься по льду на мини-конечках, у него бы это не вышло, потому что он сам слишком легкий и его веса недостаточно для такого давления на поверхность, чтобы получался необходимый для скольжения водный слой. Для муравья это было бы как катание на коньках по асфальту.
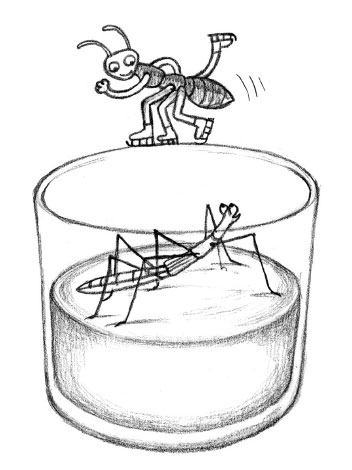
Зато некоторые насекомые могут бегать по воде, водомерки даже получили свое название благодаря этой способности. И ею они тоже обязаны водородным мостикам. Дело в том, что благодаря молекулам воды, держащимся друг за дружку водородными мостиками, водная поверхность имеет довольно высокое поверхностное натяжение – о нем мы уже упоминали в главе 3, когда говорили о мыльных пузырях. Вот еще одно сравнение: представьте себе отдельные бревна, которые поплывут по воде только связанными в плот. Если бы каждая молекула воды плавала просто сама по себе, водомерка немедля затонула бы. Но поскольку молекулы посредством водородных мостиков между собой как бы связаны (то есть будто строят плот), из поперечных связей образуется тончайшая решетка, которая и держит водомерку на поверхности.
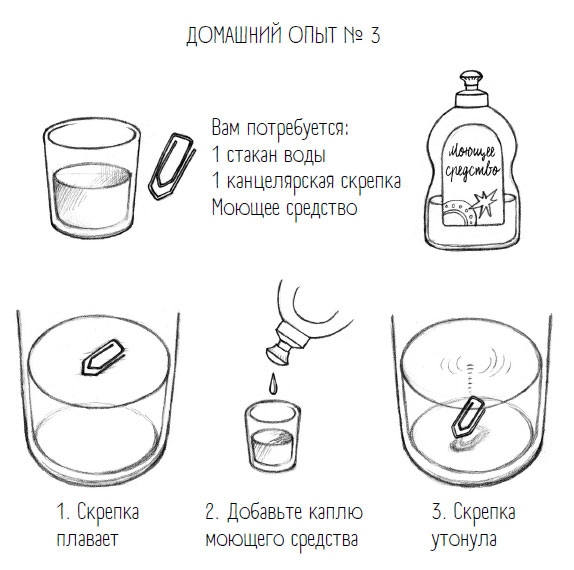
Это явление можно наблюдать на простом опыте с обычной канцелярской скрепкой: если ее аккуратно положить на водную поверхность, она поплывет. Причем несмотря на то что скрепка металлическая и плотность у нее выше, чем у воды (выражаясь разговорным языком, она тяжелее). Вообще, скрепка не должна была бы плавать, но ее несет поверхностное натяжение воды. Если уменьшить это натяжение – например, капнув в воду моющее средство, которое выпустит на поверхность несколько ПАВов, «плот размякнет», а канцелярская скрепка тут же – бульк! – и уйдет под воду.
Но прежде всего вода – это очень важный для нас растворитель. В ней растворяются такие жизненно важные субстанции, как соли и питательные вещества. И сам человек тоже большей частью состоит из воды, и все процессы обмена веществ в нашем организме происходят в водяном растворе. Почки – фильтр организма – с помощью воды выводят из нас отходы в форме мочи. Когда вода не служит транспортным средством или растворителем, она в качестве химически активного партнера по реакции внедряется в другие вещества и преобразуется. А о ее роли как охлаждающего средства – пота – мы уже говорили в главе 9.
Но, кажется, всего этого людям недостаточно, чтобы восхищаться водой, какая она есть. Рядом со Smart Water я обнаруживаю полку с кислородной водой – минералкой, дополнительно обогащенной кислородом. Реклама гласит, что она рекомендована тем, кто активно занимается спортом. На первый взгляд, здорово, ведь содержание кислорода в крови играет существенную роль для спортивных достижений. Поэтому EPO (допинг эритропоэтин) столь популярен среди спортсменов, практикующих высокие нагрузки, ведь это вещество повышает количество красных кровяных телец, или эритроцитов. Чем больше эритроцитов, тем больше крови может передаваться в мышцы. Получается, кислородная вода – это что-то вроде легального софт-допинга?





