Именно на поверхности ресничек как раз и расположены рецептивные белки, вставленные в клеточную мембрану. Эти белки сторожат вход в нервную систему, словно солдаты на воротах в окруженный стенами город; их задача – проверять верительные грамоты у каждой новоприбывшей молекулы и передавать принесенное ей послание внутрь клетки. На этом этапе происходит распознавание и различение разных химических структур, а клетка производит электрический импульс. Весь процесс зависит от того, насколько идеально молекула одоранта вставится в соответствующую полость белка-рецептора.
Другой хвостик нейрона, именуемый аксоном, проходит через решетчатую кость и достигает мозга, где устанавливает синапсическую связь со вторым слоем нейронов. Это зона сбора и распределения ольфакторных сигналов; она состоит из двух обонятельных луковиц, которые находятся прямо под фронтальной областью мозга: одна – слева, другая – справа. Из обонятельных луковиц сигнал передается в центральные области мозга, где проходит дальнейшую обработку, оценку и сравнивание с хранящимися в памяти данными, после чего мы получаем на выходе осознанное впечатление, словесное описание или поведенческий ответ.
Биохимия начала изучать обоняние еще в конце 1970-х, однако ольфакторные рецепторы позвоночных были открыты лишь в 1991-м – это стало важнейшей вехой в данной области [1]. Линда Бак и Ричард Аксель, авторы открытия, получили в 2004 году Нобелевскую премию за достижения в медицине и физиологии, придав колоссальный стимул дальнейшим исследованиям и вообще интересу к этой теме.
Сегодня благодаря определению геномной последовательности нам уже гораздо больше известно о количестве и природе ольфакторных рецепторов. А вот соответствующие одоранты были идентифицированы всего для нескольких из них. Да, маршрут продолжен, но от взлома обонятельного кода мы еще очень далеки и еще меньше знаем о тех путях, которыми ольфакторные сообщения путешествуют через нейронную сеть мозга, чтобы породить в конечном счете поведенческую реакцию, эмоцию или словесное описание.
Первые шаги к биохимии
Только в конце 1970-х интересующиеся ольфакцией ученые начали говорить о белках-рецепторах и способах их идентификации. Было сделано несколько разрозненных попыток, но результаты получились смутные и невоспроизводимые. Обоняние оставалось неисследованной территорией.
Даже опытные биохимики были не готовы рисковать временем и бюджетами, пускаясь в эксперименты, основанные на зыбких гипотезах и не имеющие четкой заявки на успех. Научные исследования – дело очень состязательное; они требуют значительных финансовых вложений, за которые в конце нужно отчитываться, предъявляя весомые научные результаты. Инвестиции в совершенно новую область требуют либо храбрости, либо слепого энтузиазма молодого исследователя.
Некоторые ученые в тот период даже ставили под сомнение само существование ольфакторных рецепторов в виде белков. Тогда бытовало несколько разных теорий, впоследствии опровергнутых экспериментальными данными; кое-кто полагал, что ольфакторные рецепторы могут быть просто молекулами липидов, а некоторые так и вовсе отрицали, что в носу происходит какое-то прямое взаимодействие между запахами и биохимическими структурами. Однако со временем идея о том, что улавливанием летучих молекул одорантов занимаются именно белки-рецепторы, становилась все более убедительной: помогло быстрое накопление знаний о других типах рецепторов – например тех, которые участвуют в передаче нервного сигнала.
Но задача от этого легче не стала. Даже сейчас, после расшифровки геномов человека и многих других видов животных, искать новое семейство генов, не имея никакой конкретной информации о них, – это целая проблема. Примерно как листать книгу с сотнями тысяч нуклеотидных последовательностей, не имея понятия, какие именно мы ищем и как их узнать.
Если даже на нынешнем этапе технологического развития открытие новой группы генов все еще дело трудное, 40 лет назад оно было практически безнадежным. Единственными доступными в тот период инструментами были биохимические, в том числе прямое наблюдение в лабораторных условиях на уровне белков. Такой подход обычно основан на физиологическом протоколе или бихевиоральных наблюдениях (например, обонянии запаха) и ищет ответственный за это явление белок.
Охота за новым рецептором обычно подразумевает несколько шагов. Прежде всего вам нужен надежный, быстрый и недорогой (в плане образцов) тест, способный измерить активность, а следовательно, наличие изучаемого рецептора. Скажем, лекарство или химическое вещество вообще вызывает наблюдаемую и измеряемую реакцию у индивидуума или изолированного органа. Далее вы маленькими порциями меняете структуру молекулы и смотрите, как это влияет на качество и интенсивность продуцируемого сигнала.
Говоря в общем, белок-рецептор сидит на мембране клетки (предположим, нейрона) и посылает внутрь нее информацию о присутствии посторонней молекулы. Задача экспериментатора – изолировать такой белок и изучить его характеристики. В некоторых случаях молекулу, узнанную белком-рецептором, используют как наживку, чтобы «выловить» рецептор: он связывается с веществом, и его удается изолировать от прочих химикатов и белков, содержащихся в смеси [2].
Примерно такие же техники использовались гораздо раньше для изучения ферментов. Фермент – это тоже белок, который, подобно рецептору, связывается с химическим соединением, но затем вступает с ним в реакцию, модифицирует структуру и выпускает продукт взаимодействия (см. рис. 21). Этот цикл можно повторять многократно с одной и той же молекулой фермента, причем с усилением эффекта – в данном случае химического выхода. Накопление больших количеств выходного продукта, полученных при помощи крошечных количеств фермента, делает изучение этих веществ сравнительно легким: относительно просто выдержать исходный ферментный субстрат достаточно долгое время, позволяя реакции идти своим чередом и дожидаясь той концентрации выхода, которую можно будет с легкостью измерить.
Когда простой и надежный метод, позволяющий определить присутствие фермента, наконец установлен, фермент нужно изолировать и очистить от грубого биологического экстракта путем фракционирования. В каждом таком случае мы получаем набор пробирок, содержимое которых затем анализируется на предмет наличия в нем искомого фермента. Те, в которых он есть, соединяются и подвергаются второму этапу очищения – и так далее, и так далее, пока не останется никаких других белков, кроме нашего фермента.
В случае с белком-рецептором процедура будет похожая, хотя найти способ определять наличие связывающего свой лиганд, но не производящего никакой реакции белка будет труднее (см. рис. 21). Было разработано несколько протоколов, но все они довольно сложны и при этом недостаточно точны. В классическом методе еще используются радиоактивно маркированные вещества, особенно когда лиганд – маленькая органическая молекула.
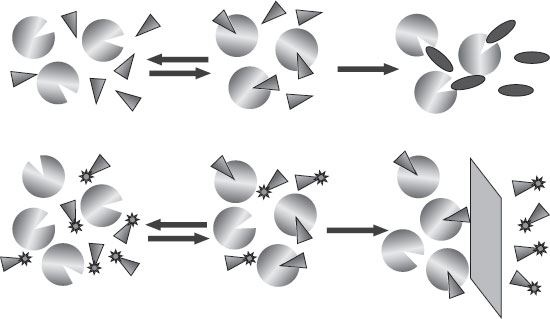
Рисунок 21. Разница между ферментами и рецепторами. Верхняя часть диаграммы показывает молекулы фермента (круги), которые обратимо связывают субстрат (треугольники) и превращают его в выходной продукт (эллипсы). Активность фермента легко измеряется посредством наблюдения за объемом выхода. В случае с рецептором не происходит никакой реакции (нижняя часть диаграммы). Связывающую активность можно измерить только после отделения белка от свободного лиганда. Если промаркировать лиганд, например, радиоактивной меткой, можно будет просто сравнить радиоактивность обеих фракций и оценить сродство лиганда и рецептора.

