Лучше всего этот принцип иллюстрирует история
[543] с накоплением мутаций. Несколько исследователей независимо друг от друга заметили, что с возрастом в тканях начинают преобладать "хитрые мутации" – такие, которые не превращают клетку в опухоль, но делают ее жизнь немного проще. Например, мутация, которая разрушает ген Notch1, позволяет клеткам пищевода не дифференцироваться (то есть не работать), а, следовательно, лучше размножаться. Соседям "хитрых" мутантов места для размножения не достается, и у них нет другого пути, кроме как дифференцироваться и работать за двоих. Это простой пример клеточной конкуренции, когда более "наглые" клетки фактически паразитируют на своих порядочных коллегах. В то же время для ткани в целом наглость оказывается вторым счастьем. Клетки с мутацией в Notch1 получают преимущество, захватывают ресурс и лишаются стимула эволюционировать дальше. Одержав промежуточную победу, они "успокаиваются" и не ищут новых высот. Вероятно, именно поэтому в них не появляются новые онкогенные мутации, например, в гене р53.
Таким образом, некоторые мутации для клеток оказываются ловушкой, дают им промежуточное превосходство и мешают двигаться вперед. Несмотря на то что сами по себе эти мутанты для тканей скорее вредны, чем полезны, в длительной перспективе это оказывается выигрышной стратегией. Другие механизмы клеточного старения – например, укорочение теломер – можно тоже представить себе в виде ловушки: попав в нее, клетка не приносит никому пользы, но и вреда от нее меньше, чем могло бы быть, останься она на плаву и превратись потом в беспощадного анархиста. И эта стратегия позволяет организму продержаться до тех пор, пока большинство клеток в ткани не окажутся в ловушке, а оставшиеся не поднимут бунт.
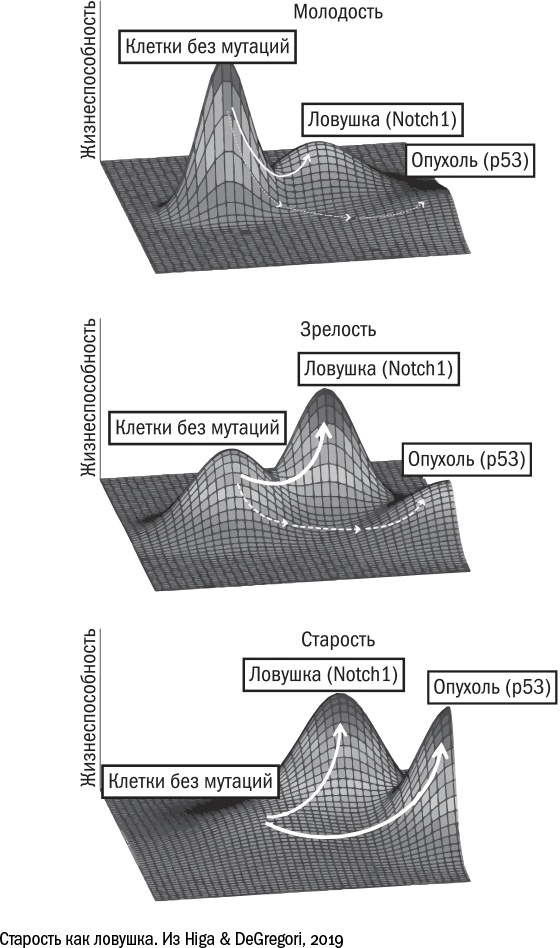
На первый взгляд может показаться, что рак и старость воюют на одной стороне – против долгой жизни человека. На деле же они конкурируют друг с другом, тем самым изрядно усложняя нам задачу. Победив рак, мы столкнемся лицом к лицу с проблемой сенесцентных клеток. Избавившись от старения, мы останемся наедине с нерешенной проблемой рака.
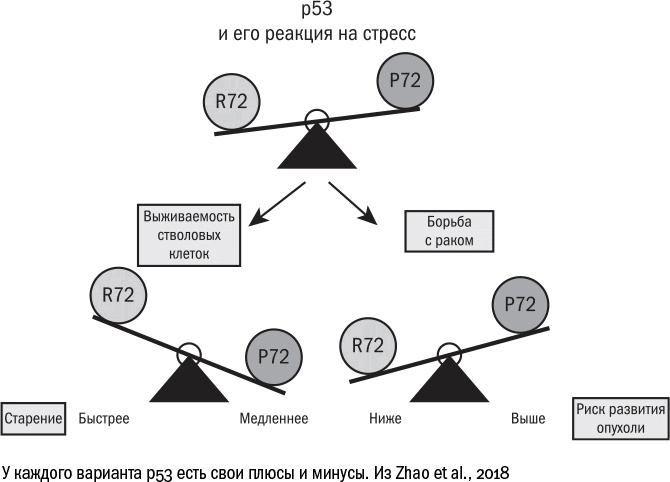
Каждый человек на самом деле уже находится на той или другой стороне этих весов. Дело в том, что у нас встречается два варианта белка р53, которые различаются всего лишь одной аминокислотой, 72-й по счету. Вариант R72 работает лучше: более прочно связывается со своими мишенями и, следовательно, эффективнее запускает в клетках старение и апоптоз. Вариант Р72 действует слабее, а его носители, по некоторым данным
[544], чаще страдают от опухолей. Зато среди долгожителей в разных популяциях
[545] (хотя и не во всех
[546]) людей с Р72 оказывается больше, чем с R72.
Оба варианта чем-то выгодны. С одной стороны, можно иметь активный белок р53 и не страдать от онкологических болезней. Но тогда суровый охранник-р53 будет останавливать деление во всех клетках, которые покажутся ему сколько-то подозрительными, и к старости в организме останется меньше клеток, способных делиться и обновлять ткани, и жизнь окажется короче. С другой стороны, можно иметь более толерантную версию р53 и повышенный риск рака. Но если человек как-то со своей опухолью справляется, то жизнь его оказывается дольше, потому что сенесцентных клеток накапливается меньше. Как говорилось в пьесе Леонида Филатова, "но какие выживают – те до старости живут". А вот заполучить одновременно и долгую жизнь, и низкий риск развития рака, кажется, невозможно. Придется выбирать.
Старикам здесь не место
Коль скоро старение клеток в борьбе с раком неизбежно, есть только один способ противостоять им одновременно – убивать сенесцентные клетки, которые представляют собой тупиковую ветвь клеточного развития. От них не приходится ждать, что они "исправятся" или вернутся к прежней жизни. А вот проблем доставляют немало: выделяют провоспалительные белки, разрушают матрикс и заражают старостью соседей.
Первый механизм избирательного отстрела старых клеток придумал
[547] геронтолог Джеймс Киркленд. Вместе с коллегами он создал трансгенных мышей INK-ATTAC. Во всех сенесцентных клетках активна область ДНК под названием INK. Киркленд встроил после нее ген АТТАС, который кодирует одну из каспаз – белков, запускающих апоптоз. Таким образом, все сенесцентные клетки в такой трансгенной мыши производили эту каспазу. А запустить ее работу можно было с помощью специального препарата – АР20187, – тогда клетка умирала посредством апоптоза.
Так у Киркленда с коллегами получился первый сенолитик – лекарство, которое уничтожает только старые клетки. Модельные мыши INK-ATTAC под действием сенолитика прожили
[548] в среднем на треть больше контрольных животных. Для достижения этого эффекта оказалось достаточно уничтожить лишь треть сенесцентных клеток в их тканях. Позже оказалось, что сенолитик помогает мышам справиться с нарушениями
[549] обмена веществ при ожирении и возрастной атрофией
[550] межпозвоночных дисков, то есть борется с возрастными болезнями.
Вдохновившись этими результатами, ученые начали искать природные сенолитики, которые действовали бы не только на модельных трансгенных животных, но и на обычных, и в перспективе – на человека. Группа Киркленда предложила
[551] искать их среди противоопухолевых лекарств. Коль скоро сенесцентные клетки – это "недоделанные" раковые, то они должны поддаваться действию тех же препаратов, но в меньшей концентрации. И Киркленд оказался прав: подавляющее большинство известных на настоящий момент сенолитиков – это противоопухолевые лекарства, только применяются они в небольших дозировках.




