Что именно случится с клеткой под действием каждого конкретного стресса – остановка цикла, старение или смерть, – предсказать сложно. Каждый сигнал тревоги заканчивается навешиванием на молекулу р53 какой-нибудь химической группы, изменяющей ее активность. И сила стресса, вероятно, измеряется в количестве и качестве
[515] модифицированных молекул р53. Возможно также, что разные типы клеток по-разному реагируют на стресс: например, лимфоциты изначально настроены на апоптоз (суровые нравы в рядах иммунитета часто предписывают всем "неудачникам", "лишним" и "промахнувшимся" умереть), а клетки кожи с большей вероятностью состарятся.
Но бывает и такое, что клеточная "совесть" не успевает отреагировать вовремя, и в клетке возникает роковая мутация. Она превращает протоонкоген – ген, который кодирует полезный белок, например стимулирующий деление, – в онкоген, то есть чересчур активный ген, который может привести к опухолевой трансформации. На этом этапе у клетки есть еще один шанс
[516] опомниться – онкоген-индуцированное старение. Повышенная активность многих протоонкогенов (таких, например, как RAS или E2F) активирует р16 – и потенциальный бунтарь превращается в немощного старика. Два возможных пути старения – через р53 (стресс-индуцированное) или через Rb (онкоген-индуцированное) – становятся ответом на разные стимулы, но заканчиваются одинаково.
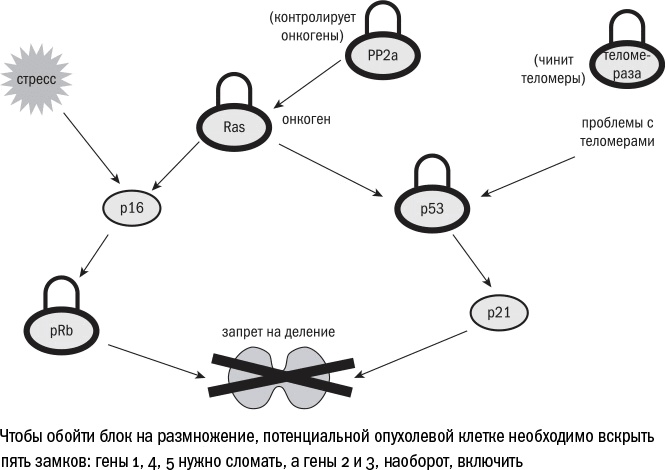
Таким образом, на пути опухолевой трансформации клетки стоит несколько баррикад. Чем больше белков-супрессоров опухоли, тем надежнее барьер. У мышей, как я уже говорила выше, защита от рака слабая. Она состоит всего из двух слоев: чтобы клетка стала раковой, необходимо "сломать" ген р53 или ген Rb, а также "улучшить" протоонкоген Ras.
У человека (как и у бобра) этих слоев целых пять: в опухоли должны быть сломаны одновременно р53, Rb и еще PP2a – фермент, инактивирующий многие протоонкогенные белки, а получить излишнюю активность должны Ras и теломераза (фермент, о котором речь пойдет дальше).
У других долгожителей есть свои рецепты идеальной баррикады. Слон, например, раздобыл себе целых 19 дополнительных копий гена р53. Эти копии неполноценные и содержат разные мутации, поэтому кодируемые ими белки не могут сами по себе вызвать старение или смерть, зато, вероятно, они стабилизируют "настоящий" р53 и каким-то образом мешают другим белками его заблокировать.
У голого землекопа, чьему успеху давно завидуют онкологи и геронтологи, баррикад четыре. Клеткам необходимо сломать два белка-супрессора опухолей – р16 и р27, – но при этом нельзя трогать р53 или Rb, их потеря немедленно приводит к апоптозу. Кроме того, клетки землекопов окружены необыкновенно длинными нитями гиалуроновой кислоты (в пять раз длиннее
[517], чем у мыши), которые блокируют деление на самых ранних этапах. Поэтому, чтобы опухоль все-таки выросла, ей необходимо либо сломать белок, который строит гиалуроновые нити, либо усилить активность белка, который их расщепляет, либо выключить пути передачи сигнала от гиалуроновой кислоты внутрь клетки (а их два, независимых друг от друга). Таким образом, чтобы пробить эту противоопухолевую защиту, нужно не менее четырех точечных попаданий. Неудивительно, что все те немногие случаи рака у голых землекопов, о которых мы знаем, произошли в лабораториях, где животные попадают в непривычно теплую и светлую среду, а значит, подвержены повышенному стрессу.
Выстрел вдогонку
А вот по части поздней защиты землекопу, наоборот, было бы чему поучиться у человека. Здесь наши клетки застрахованы лучше, чем у мелких млекопитающих. И для этого у нас работает система укорачивающихся теломер.
О теломерах в контексте старения заговорили
[518] после 1973 года, когда российский молекулярный биолог Алексей Оловников выдвинул теорию маргинотомии (дословно "отсечения концов"). Он предположил, что предел Хейфлика (остановка клеточного цикла после 50 делений) объясняется тем, что концевые участки хромосом – теломеры – исчезают, при этом "обнажая" следующие за ними жизненно важные гены. И когда те повреждаются, клетка гибнет. Он же и предложил считать этот процесс причиной старения, положив начало теломерной теории старения.
Позже, правда, сам Оловников отошел от своих представлений, предпочтя им новый вариант
[519]: старение как укорочение небольших молекул ДНК, отдельных от хромосом. Ответственными за старение в его новой теории стали гормональные колебания, вызванные изменениями гравитации под влиянием Луны, а воспринимает организм эти изменения, по мнению Оловникова, с помощью специальной луносенсорной системы (в которую входит эпифиз – шишковидная железа головного мозга, ответственная за биологические ритмы). У этой экстравагантной гипотезы, в отличие от теломерной теории, последователей пока не нашлось, хотя о роли биоритмов в процессе старения в последнее время говорят все больше, и мы тоже поговорим в последней главе.
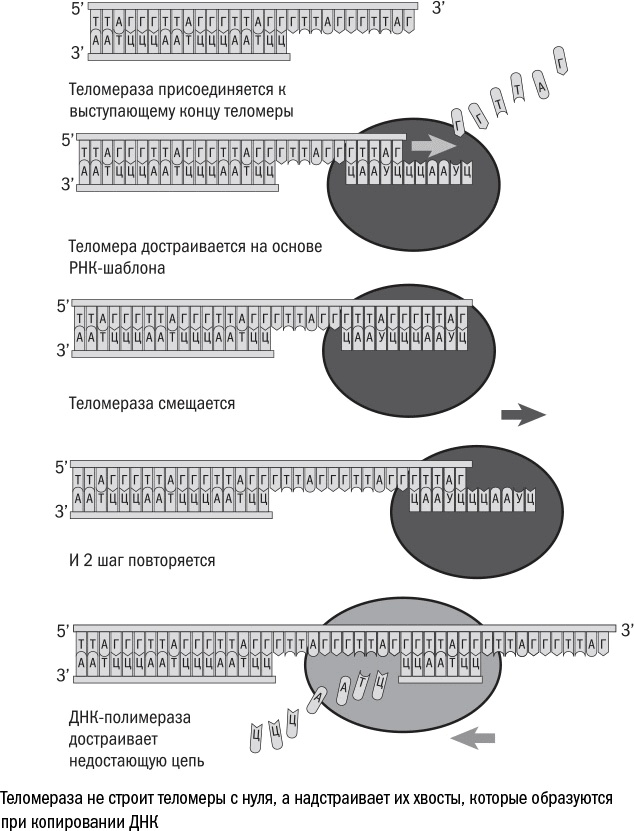
Но в некоторых случаях укорочение теломер невозможно: если бы хромосомы только и делали, что укорачивались, то каждому следующему поколению животных доставались бы все более короткие теломеры. Оловников предположил, что в половых клетках должен работать фермент, способный копировать ДНК без потери теломер. Десять с лишним лет спустя Элизабет Блэкберн и Кэрол Грайдер обнаружили, что такой фермент действительно существует, и назвали его теломеразой. Правда, работает она по-другому: она не копирует всю хромосому целиком, а занимается только восстановлением концов. Это сделать несложно, поскольку все теломеры состоят из "шестибуквенной" последовательности ТТАГГГ, повторенной более тысячи раз. Теломераза приносит "с собой" нить РНК – шаблон, по которому она может восстановить нужную последовательность. Она "прикладывает" шаблон к концу ДНК и достраивает одну из цепей, а вторую восполняет уже обычная клеточная полимераза. И теоретически ничто не мешает клетке, в которой работает теломераза, жить вечно.




