Биология – настолько широкое поле деятельности, что есть уйма проблем, о которых мы даже не упоминаем; скажем, вопрос о том, как осуществляется зрение (что свет делает внутри глаза) или как работает ухо и т. д. (Как работает мысль, мы обсудим позже, когда будем говорить о психологии.)
Так вот, все эти вопросы, стоящие перед биологией, на самом деле для биолога отнюдь не главные, отнюдь не они лежат в основе жизни. Если мы их и поймем, нам все равно не понять сущности жизни. Вот вам пример: люди, изучающие нервы, понимают, что их работа очень нужна, ведь животных без нервов не бывает. Но жизнь без нервов возможна. У растений нет ни нервов, ни мышц, и все же они работают, живут (что одно и то же). Значит, самые фундаментальные проблемы биологии нужно искать глубже.
При этом мы установим, что у всех живых существ есть много общих черт. Самое же общее между ними то, что они состоят из клеток, внутри каждой из которых действует сложный механизм химических превращений. В растительных клетках, например, есть механизм поглощения света и выработки сахарозы, которая потом в темноте поглощается, поддерживая жизнь растения. Когда животное поедает растение, сахароза порождает в животном цепь химических реакций, тесно связанных с фотосинтезом растений (и обратной цепочкой в темноте).
В клетках живых организмов происходит множество хитро задуманных химических реакций: одно соединение превращается в другое, затем в третье, затем еще и еще. Фиг. 3.1 дает некое представление о гигантских усилиях, предпринятых в изучении биохимии; там сведены воедино наши знания о малой доле того множества цепочек реакций (может быть, примерно 1% общего количества), которые происходят в клетке.
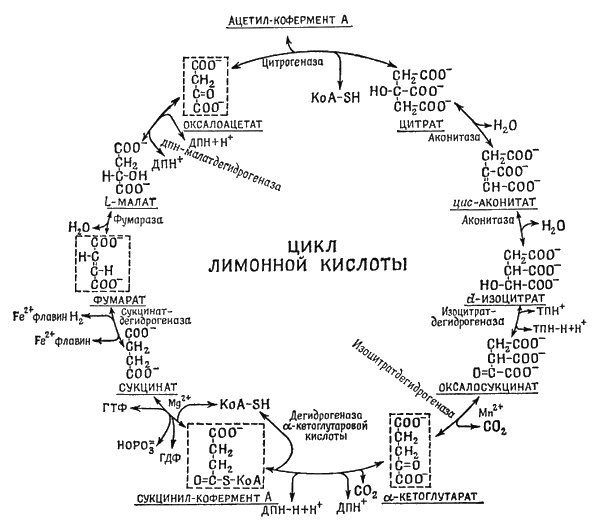
Фиг. 3.1. Цикл Кребса.
Вы видите здесь ряд молекул, последовательно превращающихся одна в другую, – цикл с довольно мелкими шагами. Это – цикл Кребса, или дыхательный цикл. Судя по изменениям в молекулах, каждое вещество и каждый шаг в цикле довольно просты. Но эти изменения относительно трудно воспроизводятся лабораторным путем. Это открытие необыкновенной важности в биохимии. Дело вот в чем. Если есть два сходных вещества, то как раз их-то часто нельзя превратить друг в друга, потому что эти две формы обычно отделены энергетическим барьером, «перевалом». Ведь, желая перенести предмет на новое место на том же уровне по другую сторону перевала, вы сперва должны поднять его над перевалом. Это требует добавочной затраты энергии. По той же причине многие реакции не происходят, им не хватает так называемой энергии активации. Если вы хотите присоединить к химическому соединению лишний атом, то для того, чтобы он пристал куда надо, его следует придвинуть вплотную, иначе нужная перестановка не произойдет, он лишь немного взбежит по «склону» и скатится обратно. Но если б вы могли, буквально повертев молекулу в руках, раздвинуть ее атомы, ввести в образовавшуюся дыру ваш атом и затем закрыть отверстие, то вы бы миновали подъем, никакой затраты энергии не понадобилось бы и реакция прошла бы легче. Так вот, в клетках и впрямь существуют очень большие молекулы (куда больше, чем те, чьи изменения изображены на фиг. 3.1), которые как-то умеют расставить малые молекулы так, чтобы реакция протекала без труда. Они, эти большие сложные устройства, называются ферменты (или закваска; назвали их так потому, что обнаружили их при сбраживании сахара. Кстати, первые из реакций цикла Кребса были открыты именно при сбраживании). Реакции цикла идут только в присутствии ферментов.
Сам фермент состоит из другого вещества – белка. Молекулы ферментов велики и сложны. Все ферменты отличаются друг от друга, причем каждый предназначен для контроля некоторой определенной реакции. На фиг. 3.1 возле каждой реакции обозначены названия нужного фермента (а иногда один фермент контролирует и две реакции). Подчеркнем, что сам фермент в реакцию не вовлекается. Он не изменяется, его дело только передвинуть атом с одного места в другое. Передвинет в одной молекуле и готов уже заняться следующей. Совсем как станок на фабрике, причем должен иметься запас нужных атомов и возможность избавляться от ненужных. Возьмите, например, водород: существуют ферменты, имеющие специальные ячейки для переноса водорода в любой химической реакции. Скажем, имеются три или четыре фермента, которые понижают количество водорода; они используются во многих местах цикла. Интересно, что механизм, высвобождающий водород в одном месте, придерживает этот атом, чтобы использовать его еще где-нибудь.
Важнейшая деталь цикла, приведенного на фиг. 3.1, это превращение ГДФ в ГТФ (гуаназиндифосфат в гуаназинтрифосфат), потому что во втором веществе – ГТФ – энергии намного больше, чем в первом. Подобно тому как в некоторых ферментах имеется «ящик» для переноса атомов водорода, бывают еще особые «ящики» для переноса энергии; в них входит трифосфатная группа. В ГТФ больше энергии, чем в ГДФ, и когда цикл идет в одну сторону, создаются молекулы с избытком энергии; они могут привести в действие другие циклы, которым требуется энергия, например цикл сжатия мышцы. Мышца не сократится, если нет ГТФ. Можно поместить в воду мышечное волокно и добавить туда ГТФ, тогда волокно сократится, превращая ГТФ в ГДФ (если только присутствуют нужные ферменты). Таким образом, сокращение мышцы есть превращение ГДФ в ГТФ; накопленный в течение дня ГТФ используется в темноте для того, чтобы пустить весь цикл в обратную сторону. Как видите, ферменту все равно, в какую сторону идет реакция; если б это было не так, нарушался бы один из законов физики.
Есть и другой резон, по которому для биологии и других наук важна именно физика, – это техника эксперимента. Например, нарисованная биохимическая схема не была бы еще до сего времени известна, если бы за нею не стояли большие достижения экспериментальной физики. Дело в том, что для анализа этих невообразимо сложных систем нет лучшего средства, нежели ставить метки на атомах, участвующих в реакции. Если ввести в цикл немного углекислоты с «зеленой меткой» на ней и посмотреть, где метка окажется через 3 сек, потом через 10 сек и т. д., то можно проследить течение всей реакции. Но как сделать «зеленую метку»? При помощи различных изотопов. Напомним, что химические свойства атомов определяются числом электронов, а не массой ядра. Но в атоме углерода, к примеру, может быть либо шесть, либо семь нейтронов наряду с обязательными для углерода шестью протонами. В химическом отношении атомы С12 и С13 не отличаются, но по массе и ядерным свойствам они различны, а значит, и различимы. Используя эти изотопы, можно проследить ход реакции. Еще лучше для этого радиоактивный изотоп С14; с его помощью можно весьма точно проследить за малыми порциями вещества.
Вернемся, однако, к описанию ферментов и белков. Не все белки – ферменты, но все ферменты – белки. Существует множество белков, таких как белки мышц, структурные белки, скажем, в хрящах, волосах, коже, не являющихся ферментами. И все-таки белки – очень характерная для жизни субстанция; во-первых, это составная часть всех ферментов, а во-вторых, составная часть многих иных живых веществ. Структура белков проста и довольно занятна. Они представляют собой ряды, или цепи, различных аминокислот. Существует два десятка разных аминокислот, и все они могут сочетаться друг с другом, образуя цепи, костяком которых являются группы СО-NH и т. п. Белок – это всего лишь цепочки, сложенные из этих 20 аминокислот. Каждая аминокислота, по всей вероятности, служит для каких-то специальных целей. В некоторых аминокислотах в определенном месте находится атом серы; два атома серы в одном и том же белке образуют связь, т. е. схватывают цепь в двух точках и составляют петлю. В других есть избыточный атом кислорода, придающий им кислотные свойства; характеристики третьих – щелочные. В некоторых бывают большие группы атомов, свисающие с одной стороны и занимающие много места. Одна из аминокислот – пролин – в действительности не амино-, а иминокислота. Эта небольшая разница приводит к тому, что когда в цепи есть пролин, то цепь перекручивается. Если бы вы захотели создать какой-то определенный белок, то вам пришлось бы дать такие указания: здесь поместите серный крюк, затем добавьте чего-нибудь, чтобы заполнить место, теперь привяжите что-нибудь, чтобы цепь перекрутилась, и т. д. Получились бы скрепленные между собой замысловатые цепочки со сложной структурой; все ферменты, по-видимому, устроены именно так. Одним из триумфов современной науки было открытие (в 1960 г.) точного пространственного расположения атомов некоторых белков; в них 56–60 аминокислот подключены друг за другом. Было установлено точное местоположение свыше 1000 атомов (даже до 2000, если считать и водород), входящих в сложную структуру двух белков (один из них – гемоглобин). А одна из печальных сторон этого открытия проявилась в том, что из этой картины ничего увидеть нельзя; мы не понимаем, почему она такая. Именно эту проблему и следует сейчас атаковать.



