Стало ясно, что возможности для применения редактирования генома ex vivo в клинике невероятно разнообразны, независимо от того, что именно предстоит лечить – генетические заболевания или вирусные инфекции. Но, конечно, не все болезни коренятся в крови. В случае заболеваний, поражающих “твердые” ткани тела, врачи не могут рассчитывать на методы лечения, требующие извлечения и возвращения поврежденных клеток; аналогичные процедуры в таких случаях будут слишком рискованными и потребуют излишнего инвазивного вмешательства. Чтобы лечить подобные заболевания, нам необходимо доставить CRISPR в тело пациента, к ткани, в которой болезнь проявляется наиболее сильно. И хотя до того момента, когда этот способ лечения можно будет в самом деле предложить пациентам, еще пройдет немало времени, в данной области уже налицо прогресс – в том числе самые невероятные разработки в области медицины из всех, что мне доводилось видеть.
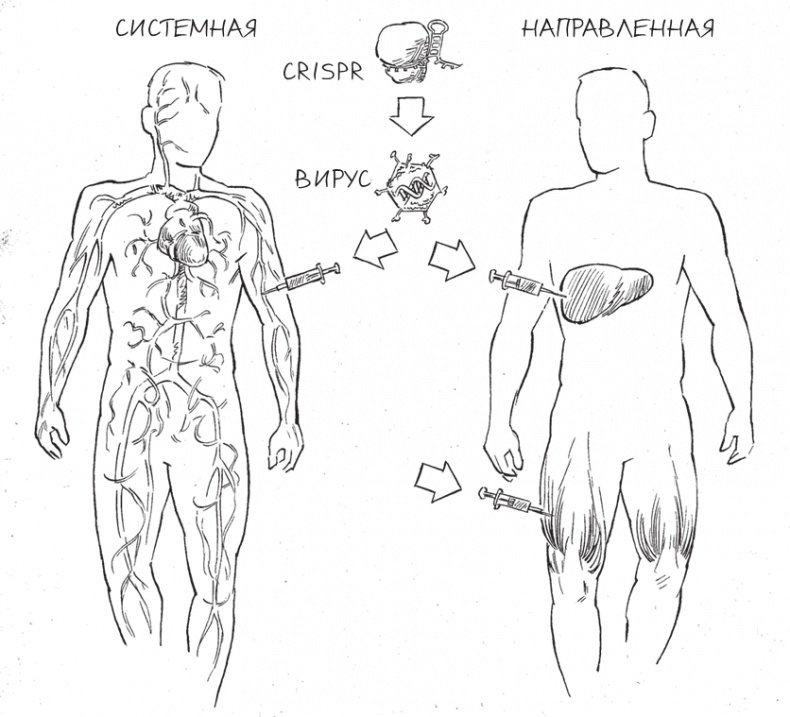
Прежде чем мы сможем лечить пациентов методами редактирования генома in vivo, ученым предстоит решить множество задач, которые редактирование генома ex vivo аккуратно обходит стороной. Врачам нужно понять, как доставить CRISPR в ткани, наиболее затронутые конкретной болезнью. Кроме того, доставку необходимо осуществить таким образом, чтобы не спровоцировать иммунный ответ в телах пациентов. Далее, Cas9 и его направляющая РНК должны быть достаточно стабильными, чтобы дожить в теле до момента окончания редактирования.
Чтобы решить эти задачи, некоторые ученые, работающие с CRISPR, обратились к одному из своих любимых средств доставки – вирусам. Вирусы невероятно искусны в “подкидывании” генетического материала в клетки хозяев – в конце концов, они оттачивали это мастерство миллионы лет. Вирусы хорошо приспособлены к заражению конкретных типов тканей и органов, при этом использование некоторых вирусов стало сравнительно безопасным. Благодаря десятилетиям генной инженерии удалось полностью перевооружить специализированные вирусы таким образом, чтобы они все же могли доставить ДНК в тело – либо в организм в целом, либо к конкретному органу, – но не были способны заразить своих хозяев ничем, кроме терапевтического “полезного груза”, введенного в них исследователями.
Один из векторов – так в генетике называют носителей генетической информации – оказался особенно важным подспорьем для ученых, разрабатывающих варианты редактирования генома in vivo: это безобидный вирус человека, известный как аденоассоциированный вирус (ААВ). ААВ вызывает лишь слабый иммунный ответ, и не известно ни одной болезни человека, которую вызывал бы этот вирус. Этот вирусный вектор легко можно “нагрузить” терапевтическими генами, кодирующими белок Cas9 и направляющую его РНК, – и вирус крайне эффективно доставит свой генетический материал к клеткам хозяина. Более того, вирус можно запрограммировать таким образом, что он не встроит свою ДНК в геном человека навсегда, так, как это делает большинство вирусов. Это свойство помогает избежать вставки неуместной ДНК в геном – именно это затрудняло попытки такой терапии в прошлом.
CRISPR-терапия in vivo
Еще одна удобная особенность ААВ – необычайное многообразие форм. Изолируя различные штаммы вируса и затем комбинируя их в различных соотношениях, ученые собрали семейство ААВ-векторов, чьими мишенями могут быть клетки во множестве различных типов тканей. Один из штаммов ААВ может лучше всего подходить для доставки CRISPR в клетки печени, в то время как другой наиболее эффективно работает в центральной нервной системе, легких, глазах либо сердечных и скелетных мышцах.
Именно в мышцах мы увидели одну из самых первых и наиболее ярких демонстраций того, что CRISPR может облегчить симптомы генетического заболевания in vivo. Хотя действие технологии пока испытали только на мышах, есть все основания полагать, что она будет эффективной и в организме человека – не в последнюю очередь потому, что генетическое заболевание, которое пытались лечить с помощью CRISPR, к сожалению, часто встречается у представителей нашего вида.
Смертельная болезнь, истощающая мышцы, – мышечная дистрофия Дюшенна (МДД) – наиболее распространенный тип мышечной дистрофии в мире; ее наследует примерно 1 из 3600 появившихся на свет мальчиков. У пациентов с МДД при рождении нет симптомов болезни, но она проявляется – и прогрессирует с ошеломляющей скоростью – в возрасте около четырех лет. Дети, пораженные МДД, страдают от тяжелой мышечной дистрофии; к десяти годам они обычно уже прикованы к инвалидной коляске, а к двадцати пяти годам большинство из них умирает от затруднений дыхания и от истощения самой главной мышцы тела – сердечной.
Миодистрофия Дюшенна может быть результатом одной из нескольких мутаций в гене DMD – самом крупном из известных генов человека, который кодирует белок под названием дистрофин. Этот белок помогает мышечным волокнам сокращаться, и нехватка функциональных молекул белка дистрофина – основная проблема в случае пациентов с МДД. У мужчин болезнь проявляется значительно чаще; поскольку ген DMD находится на X-хромосоме, а у мужчин в каждой клетке только одна такая хромосома (ее пара – Y-хромосома, наследуется от отца), единственная мутантная копия гена DMD оставляет организм без единой “здоровой” молекулы дистрофина. Напротив, у женщин в каждой клетке две X-хромосомы, а значит – две копии DMD; до тех пор пока одна из двух копий имеет нормальное строение, она способна предотвращать разрушительные симптомы заболевания. И хотя эти женщины не страдают МДД, они являются носителями заболевания и передадут мутантный ген DMD примерно половине своих потомков мужского пола. (Такой характер наследования делает МДД примером рецессивного заболевания, сцепленного с X-хромосомой.)
Сможет ли CRISPR обратить вспять развитие МДД? Ответ на этот вопрос еще предстоит получить – нам все еще потребуются годы доклинических и клинических исследований, – но если недавние эксперименты на мышах о чем-то говорят, есть основания полагать, что терапия in vivo поможет это сделать. К концу 2015-го не менее четырех независимых лабораторий доставили CRISPR в клетки половозрелых мышей, страдающих от мышечной дистрофии, и показали, что разрушительное течение болезни можно обратить вспять
[206]. Поместив генетические инструкции для CRISPR в ААВ-векторы, исследователи восстановили волокна скелетных и сердечных мышц либо введением нагруженных этими инструкциями вирусов в мышцы мышей, либо доставкой вирусов в те же ткани через кровоток. Ученые успешно “включили” здоровые гены дистрофина, и у мышей, на которых подействовали таким образом, сила мышц после терапии значительно увеличилась.
Я посетила доклад об этом исследовании, прочитанный Эриком Олсоном, профессором Юго-Западного медицинского центра Техасского университета, и меня воодушевили новые результаты применения CRISPR-терапии in vivo. Работа, о которой идет речь, вселяет в меня надежду, что однажды станет возможным устранять симптомы или даже полностью излечивать другие генетические заболевания, не только МДД. К примеру, используя вариант CRISPR, запрограммированный на редактирование другого гена, и вариант ААВ, наиболее подходящий для доставки в печень, команда исследователей из МТИ применила редактирование генома, чтобы избавить мышей от генетической мутации, вызывающей тирозинемию
[207]. У людей эта болезнь может приводить к накоплению токсичных продуктов обмена и обширному повреждению печени; если ее не лечить, пациенты обычно погибают, не достигнув десятилетнего возраста. В модели болезни на мышах тем не менее CRISPR “починил” поврежденный ген и обратил ход заболевания.



