Вначале выясним, что скрывается за звучным словом «ароматичность». Этот термин ввел Ф. Кекуле, который установил в 1865 г. строение бензола и предложил для него циклическую формулу. Название «ароматический» связано с тем, что некоторые производные бензола – бензальдегид, бензиловый спирт, эфиры бензойной кислоты – были выделены из ароматических масел и бальзамов; кстати, нитробензол имеет запах миндаля. Кекуле обратил внимание на то, что двойные связи в бензоле и в его производных заметно отличаются по свойствам от двойных связей в большинстве ненасыщенных соединений. Для бензола оказались крайне затруднены реакции присоединения по двойным связям, которые в случае ненасыщенных соединений проходят легко.
Говоря иначе, бензол, в отличие от обычных ненасыщенных соединений, в процессе различных реакций старается сохранить свою циклическую форму с чередующимися простыми и двойными связями. Наиболее характерны для бензола реакции не присоединения, а замещения. Для этого могут быть использованы только окружающие атомы водорода, причем их замена на какую-либо группу предсказуемым образом влияет на реакционную способность остальных атомов водорода.
Некоторое время ароматичностью считали набор указанных химических свойств, но постепенно были найдены более точные признаки, основанные на особенностях электронного строения. В современном понимании это выглядит следующим образом: в образовании двойных связей участвуют р-электроны атомов углерода, орбитали (область наиболее вероятного расположения электрона в пространстве) которых имеют форму объемных восьмерок. В случае бензола р-орбитали взаимоперекрываются, образуя кольцевые молекулярные орбитали, на которых и располагаются эти электроны (рис. 7.1).
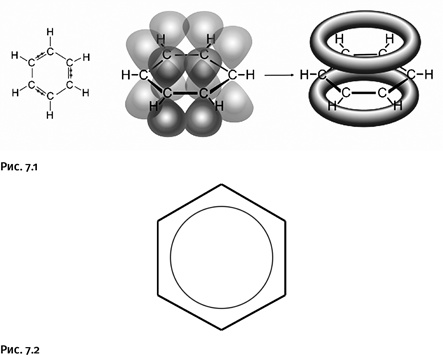
В результате появляется единая замкнутая электронная оболочка, система приобретает высокую стабильность. Фиксированные простые и двойные связи в бензоле отсутствуют, все связи С – С усреднены и эквивалентны, поэтому нередко для обозначения ароматичности используют кольцо, помещенное внутри цикла (атомы водорода часто не показывают) (рис. 7.2). Именно замкнутая электронная оболочка служит причиной того, что заместитель (например, метильная группа или галоген), введенный вместо одного атома водорода, способен передать свое влияние на остальные атомы водорода и изменить их склонность к последующему замещению.
Постепенно были сформулированы общие признаки ароматических соединений: это плоские циклические молекулы, причем количество электронов, объединенных в единую циклическую систему, должно быть строго определенным. Немецкий химик Э. Хюккель на основании квантовохимических расчетов вывел правило, указывающее, сколько электронов должно быть в циклической молекуле, чтобы она стала ароматической. В общем виде количество электронов х, удовлетворяющее правилу Хюккеля, рассчитывают по формуле х = 4n + 2 (где n – число натурального ряда, т. е. 0, 1, 2, 3 и т. д.). Таким образом, циклические молекулы, имеющие 2, 6 (бензол) или 10 электронов, обладают ароматичностью.
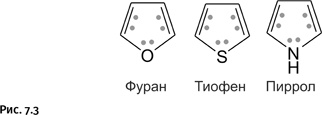
Со временем круг соединений, причисляемых к ароматическим, расширился. Этот термин оказался применимым также к соединениям небензольного типа, обладающим в то же время набором структурных признаков, характерных для бензола, иными словами, это циклические структуры с чередующимися простыми и двойными связями. Кроме того, они удовлетворяют правилу Хюккеля. В состав цикла помимо углерода могут входить атомы O, S или N (гетероциклические соединения), это молекулы фурана, тиофена, пиррола. Так же, как в бензоле, у них устойчивая – в соответствии с правилом Хюккеля – шестиэлектронная замкнутая система. Дело в том, что неподеленная электронная пара у гетероатома O (или S, или N) тоже способна участвовать в образовании замкнутой электронной системы. Четыре р-электрона (показаны точками на рис. 7.3) участвуют в двойных связях цикла, а два р-электрона (точки у соответствующего гетероатома) дают атомы кислорода, серы или азота, имеющие неподеленную пару электронов.
Если основные структурные признаки соблюдены (плоское кольцо и необходимое количество р-электронов), то и появляются соответствующие химические признаки ароматичности: молекула стабильна, реакции присоединения затруднены, но зато легко протекают реакции замещения; замкнутая электронная система при этом сохраняется. Как видим, количество атомов в цикле (5 – у гетероциклов, 6 – у бензола) решающего значения не имеет.
Судьба некоторых молекул необычна: яркое, эффектное появление, затем следует долгое прозябание, иногда даже полное забвение, а потом неожиданный расцвет. Далее речь пойдет об одном из показанных выше соединений – о тиофене.
Конфуз привел к открытию
Немецкий химик А. Байер, заложивший основы химии красителей, в 1905 г. был удостоен за свои работы Нобелевской премии. Наиболее яркое его достижение – выяснение строения природного красителя индиго и последующий синтез этого соединения. Один из ранних результатов работы Байера, далеко не самый известный, имел неожиданное продолжение. Изучая в 1879 г. строение индиго, он получил продукт его окисления – изатин, который, как оказалось, обладал интересным свойством – при смешивании с бензолом в присутствии серной кислоты давал интенсивное синее окрашивание. В результате это соединение стали использовать как очень удобный реагент для качественного обнаружения бензола. Это было заблуждением, которое продолжалось сравнительно недолго. В 1883 г. другой немецкий химик, В. Мейер, (рис. 7.4) во время чтения лекции решил показать студентам эффектный опыт, позволяющий обнаружить бензол с помощью цветной качественной реакции, однако у него под руками не оказалось бензола. Не растерявшись, Мейер решил на глазах у студентов вначале получить бензол, а затем подтвердить его наличие, подействовав изатином. Бензол он получил, нагревая бензойную кислоту (рис. 7.5).

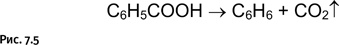
Добавив к свежеполученному бензолу серную кислоту и изатин, он с изумлением убедился, что никакого окрашивания нет. Можно себе представить веселое оживление студентов, увидевших столь неудачный результат. Тем не менее Мейер сумел сделать из этого наблюдения очень интересный и, как оказалось, абсолютно правильный вывод. То, что он получил из бензойной кислоты бензол, сомнения не вызывало. Более того, бензол, полученный таким образом, был абсолютно чистый, а бензол, которой обычно использовали химики для работы, получали из каменноугольной смолы. Следовательно, как предположил Мейер, каменноугольный бензол содержит какую-то примесь, которая дает окрашивание с изатином. Он сумел выделить из каменноугольного бензола это соединение, которое назвал тиофеном. Первая часть названия «тио» происходит от греч. theion – сера, а вторая часть названия – фен – оказалось на редкость удачной, она указывала на родство с бензолом, спутником которого был тиофен (группу, содержащую бензольное ядро С6Н5– называют фенильной). В дальнейшем оказалось, что у них есть более глубокое сходство – ароматичность.

