Как преодолеть узкое место?
Модифицированием свойств натурального каучука химики занялись довольно давно. Один из самых удачных результатов был получен, когда в молекуле изопрена H2C=CH – C(CH3)=CH2 (мономер, из которого образуется натуральный каучук) метильную группу заменили хлором H2C=CH – C(Cl)=CH2, получив хлоропрен (рис. 3.33).
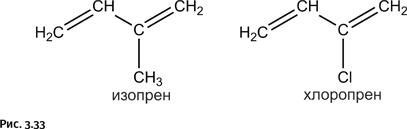
Полимерный хлоропрен, называемый обычно хлоропреновым каучуком, исключительно устойчив к действию бензина и масел. Получают хлоропрен по следующей цепочке процессов: вначале галогенируют бутадиен (углеводород с двумя двойными связями), при этом одна из двойных связей раскрывается, присоединяя два атома хлора, в результате возникают два продукта: а) симметричный, у которого атомы хлора расположены на концевых атомах углерода, и б) несимметричный, когда атомы хлора находятся у соседних атомов углерода (рис. 3.34).
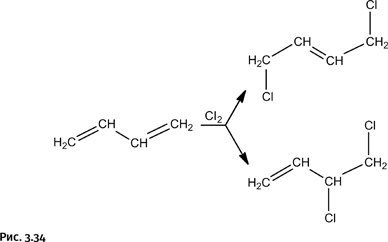
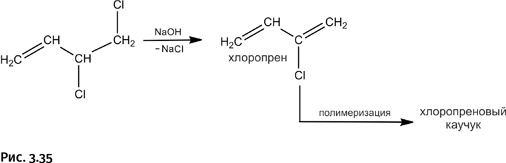
Симметричный продукт для получения хлоропренового каучука не годится, нужен только несимметричный. От него отщепляют HCl действием щелочи, при этом возникает новая двойная связь – образуется хлоропрен, который затем полимеризуют с получением хлоропренового каучука (рис. 3.35).
На всех стадиях, кроме самой первой, выход составляет 95–98 %, узкое место – первая стадия (результат галогенирования), поскольку несимметричный продукт, необходимый для дальнейших превращений, образуется в количестве почти вдвое меньшем, чем симметричный. В связи с этим в технологическую цепочку включают еще одну стадию, которая позволяет симметричное соединение перевести в несимметричное. Фактически это изомеризация, но провести ее можно только в присутствии катализатора, потому процесс и называют каталитической изомеризацией. Процесс обратимый, что обозначено сдвоенными стрелками. Таким образом, 100 %-ное превращение осуществить невозможно, система дойдет до равновесия, и образуется смесь обоих соединений, что уже неплохо, так как часть нужного продукта мы все же получим (рис. 3.36).
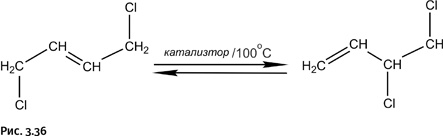
Катализатор не может сдвинуть равновесие: если в его присутствии увеличивается скорость прямой реакции, то соответственно возрастает скорость и обратного процесса. Таким образом, задача катализатора – ускорить обе реакции одновременно, т. е. сократить время, необходимое для достижения равновесия. Далее задача решается чисто технически: после того как равновесие достигнуто, из реакционной массы отгоняют несимметричный продукт, а в оставшейся реакционной смеси вновь восстанавливается его равновесная концентрация. Чем быстрее с помощью катализатора достигается равновесие, тем лучше работает катализатор и, следовательно, тем эффективнее процесс.
Применяемые для этого катализаторы – нафтенат меди либо ее галогенид – малоэффективны и довольно быстро теряют активность. В поисках новых катализаторов ученые обратились к металлоорганосилоксанам – соединениям, содержащим группировки – RSi – O-M – О – RSi – O–. Они привлекательны тем, что позволяют вводить в их структуру различные атомы металлов, плавно регулируя атомное соотношение M/Si, кроме того, они растворимы в большинстве органических растворителей, что увеличивает диапазон их использования.
Металлоорганосилоксаны, содержащие фрагменты – SiR – O – M–, в роли катализаторов ранее не изучались в процессах такого типа, но они оправдали возлагаемые на них надежды: конверсия (степень превращения) симметричного продукта в несимметричный (в течение 1 часа) составила 72 %, что почти в четыре раза выше, чем на использованных прежде катализаторах.
Наиболее заметное отличие нового катализатора от изученных прежде – исключительно высокая стабильность каталитических свойств: многократное использование такого катализатора (6–10 раз) не приводит к заметному снижению его активности.
Галогенировать без элементарного галогена
Хлорсодержащие углеводороды служат исходными соединениями при получении самых разнообразных органических веществ, в связи с чем галогенирование входит в круг многотоннажных процессов органического синтеза, однако такие процессы экологически неблагоприятны из-за использования элементарного хлора.
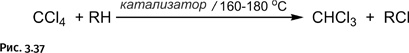
Существуют иные пути получения хлоруглеводородов: например, обменное галогенирование CCl4 с алканами, когда алкан «забирает» хлор у хлорсодержащего соединения (рис. 3.37).
Взаимодействие пары реагентов декан С10Н12 – четыреххлористый углерод CCl4 катализируют различные комплексы меди, однако в процессе работы они быстро теряют активность. Медьсодержащий силоксан по каталитической активности заметно уступает комплексам меди (в 4–5 раз), но превосходит по стабильности каталитических свойств, его активность практически не снижается после пятикратного использования, в то время как эталонный катализатор полностью теряет работоспособность в течение одного цикла.
Подробное изучение процесса показало, что увеличение содержания катализатора не приводит к существенному возрастанию конверсии (превращение исходного соединения в конечный продукт). То же самое наблюдали в другом похожем процессе.
Если катализатор не ведет к селективности
В процессе обменного галогенирования хлор присоединяется к любому из атомов углерода в декане, в результате образуется смесь монохлорированных соединений (не затрагиваются практически лишь концевые СН3-группы). Такая низкая селективность (избирательность) обычно не удовлетворяет химиков, частично проблему можно решить, изменив строение исходного реагента. Если вместо алкана взять алкен (углеводород с двойной связью), то положение двойной связи само укажет то место, куда должен присоединиться Cl и, соответственно, фрагмент CCl3. Это было проверено с использованием октена C6Н13CН=CH2 (рис. 3.38).

Так же, как в предыдущих двух процессах, катализатор сохранял стабильность каталитических свойств при многократном использовании. Интересно, что вновь подтвердилось отмечавшееся явление: максимальная активность катализатора (определяемая как степень превращения, приходящаяся на один каталитический центр) наблюдается только при очень малом его содержании.
Явно прослеживалась закономерность, с которой необходимо было разобраться. Это нельзя было объяснить тем, что часть каталитических центров находилась в глубинных слоях катализатора и была недоступна для процесса. Объяснение получили при изучении особенностей строения самого катализатора, о чем речь пойдет ниже.

