Способы утилизации энергии света, довольно разнообразные по своей биохимической природе, объединяются под общим названием “фотосинтез”. Способы утилизации химической энергии еще разнообразнее, один из них — это знакомое нам по собственному опыту дыхание. Но в любом случае каждый живой организм так или иначе получает свою энергию. А что он делает с ней дальше? Ясно, что использует, но как?
Тут возникает вот какая проблема. Дело в том, что энергоемких биологических процессов — великое множество. Даже в самой простой бактериальной клетке одновременно идет несколько десятков таких процессов, причем совершенно разных по своей природе. Все они, естественно, требуют обеспечения энергией, которая именно для этого и усваивается организмом. Но очевидно, что при таком разнообразии конечных потребителей энергия, откуда бы она ни поступала, должна храниться в клетках в какой-то универсальной форме. Тогда она будет “свободно конвертируемой” и сможет пригодиться для чего угодно.
Долгое время биологи думали, что есть только одна — абсолютно универсальная — разновидность такой “свободно конвертируемой энергетической валюты”. Это молекулы аденозинтрифосфата, сокращенно АТФ (см. главу 7 и рис. 11.1). При распаде этих молекул выделяется энергия, которую очень удобно использовать в других химических реакциях. Действительно, значение АТФ для жизни на Земле колоссально. Но на самом деле есть не одна универсальная “энергетическая валюта”, а как минимум две. Первая — это АТФ (и некоторые аналогичные ему молекулы), а вот вторая вовсе не имеет химической природы — по крайней мере в энергии химических связей там ничего не запасается. Второй тип “энергетической валюты” — это ионные потенциалы на мембранах. Что это такое, мы узнаем чуть ниже. Сначала разберемся с уже более-менее знакомым нам АТФ, а потом — с ионными потенциалами.
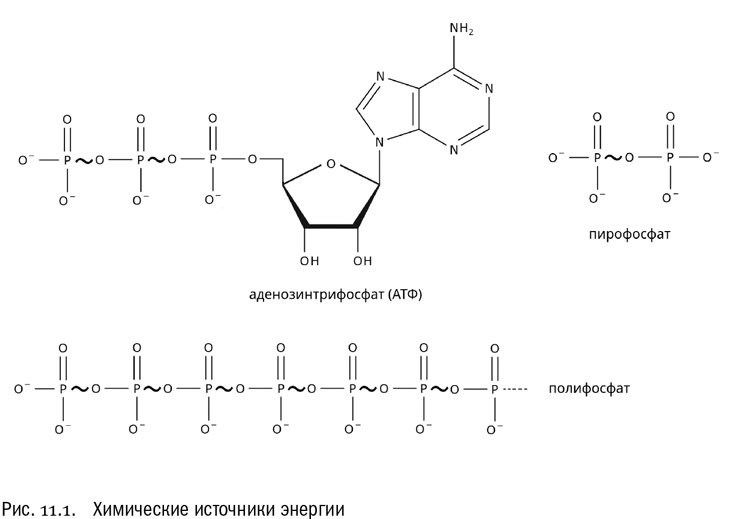
АТФ и полифосфат
Мы уже знаем, что молекула АТФ состоит из пяти частей (см. главу 7):
* аденин;
* рибоза;
* фосфатные группы (три штуки).
Энергия, пригодная для использования в живых клетках, выделяется при разрыве связей между фосфатными группами. Обратим внимание, что фосфатных групп в АТФ три, а вот связей между ними две. Если забыть про все подробности, структуру молекулы АТФ можно записать так: А–Р–Ф~Ф~Ф. Здесь А — аденин, Р — рибоза, Ф — фосфат, а волнистыми линиями по принятой традиции обозначены те самые связи, которые соединяют фосфаты между собой. Как мы уже знаем, эти связи называются макроэргическими. Именно разрыв макроэргической связи служит источником энергии, когда молекула АТФ используется по назначению. “Макроэргические” — буквально значит высокоэнергетические. На языке обычной химии связь данного типа, возникающая между двумя фосфатами с отщеплением воды, называется фосфоангидридной. На самом деле бывают и другие типы макроэргических связей, фосфоангидридная просто самая распространенная из них.
Теперь обратим внимание еще вот на что. Источником энергии в АТФ служат фосфоангидридные связи между фосфатами, и только они. К чему эти фосфаты прикреплены — не так уж важно (по крайней мере, с точки зрения получаемой энергии). Их носителем может быть рибоза в комплекте с аденином, а может быть и что-то другое. И действительно, существуют биохимические реакции, в которых источником энергии вместо АТФ (аденозинтрифосфата) служит ГТФ (гуанозинтрифосфат) или даже УТФ (уридинтрифосфат). Энергетический выход от них примерно такой же. Например, ГТФ используется как “топливо” при синтезе белка и при сборке микротрубочек, а УТФ — при создании бактериальной клеточной стенки.
А не может ли послужить источником энергии просто цепочка фосфатных групп? Оказывается, может. Без органического носителя тут вполне удается обойтись. Биохимики уже давно обнаружили, что в живых клетках довольно часто накапливается полифосфат — полимер, состоящий из множества фосфатов, соединенных друг с другом теми самыми фосфоангидридными связями. В молекуле полифосфата может быть до тысячи фосфатных остатков. Первое время биохимики думали, что это просто запасы фосфорной кислоты, и ничего больше. Возможно, у большинства организмов так и есть. Но еще в середине XX века польский биохимик Мариан Шимона обнаружил, что существуют бактерии, у которых полифосфат участвует в обмене углеводов точно так же, как АТФ
[87]. Значит, эти соединения в принципе взаимозаменяемы.
Реакцией, которую подробно изучил Шимона, было фосфорилирование глюкозы (см. главы 6 и 7). Именно с этой реакции обычно начинается усвоение глюкозы в энергетическом обмене. К молекуле глюкозы “пришивается” фосфат, и получается соединение, которое называется глюкозо-6-фосфат (цифра во всех подобных названиях относится к номеру углеродного атома в сахаре). У подавляющего большинства живых организмов источником фосфата для этой реакции всегда служит АТФ. Полифосфат используется вместо АТФ только у некоторых бактерий.
Что же это за бактерии? Заинтересовавшись этим вопросом, ученые из Института биохимии и физиологии микроорганизмов в городе Пущино провели серию сравнительных исследований (“мозгом” и руководителем этой группы был профессор Игорь Степанович Кулаев). Оказалось, что полифосфат используется вместо АТФ всего у нескольких близких друг к другу групп бактерий. Это пропионовые бактерии, микрококки, тетракокки, микобактерии и еще некоторые. Все они грамположительные, и все входят в одну достаточно компактную эволюционную ветвь, которая в современной систематике называется актинобактериями. Молекулярно-биологические данные подтверждают, что эта ветвь находится не слишком далеко от общего корня эволюционного древа клеточных организмов
[88].
Это позволило Кулаеву высказать следующую гипотезу
[89]. Фосфорилирование глюкозы с помощью полифосфатов — это “ископаемая” биохимическая реакция, которая, возможно, была свойственна очень древним формам жизни. Актинобактерии — единственная эволюционная ветвь, где она до сих пор сохранилась. А вот все остальные живые существа вместо полифосфата стали использовать АТФ.
Отсюда один шаг до предположения, что полифосфаты вообще были главными макроэргическими соединениями на заре жизни. В конце концов, они гораздо более распространены в обычной неживой природе, чем АТФ, который синтезируется практически только живыми организмами. И ведь должен же был энергетический обмен с чего-то начаться! Кулаев считал, что начаться он мог именно с полифосфатов, а уже потом переключиться на АТФ, оборот которого значительно легче регулировать.



