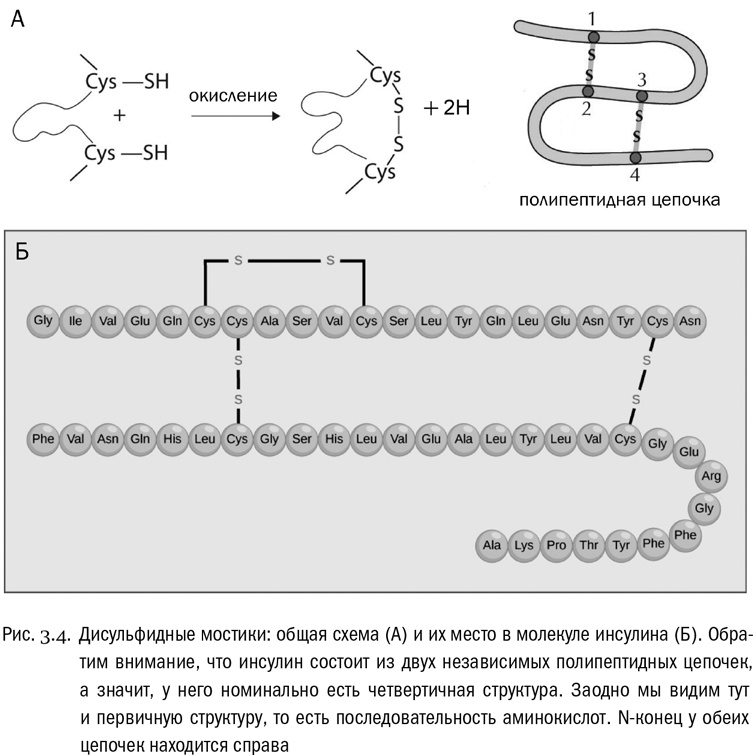
Есть и четвертый тип взаимодействий. Он зависит от единственной аминокислоты, радикалы которой могут образовать между собой аж ковалентные связи (не имеющие никакого отношения к пептидным). Эта аминокислота — цистеин. В радикале цистеина есть сульфгидрильная группа –SH, аналогичная спиртовой группе (–OH), но с атомом серы вместо атома кислорода. Целиком радикал цистеина имеет вид –CH2–SH. Так вот, уже в готовом белке может произойти реакция, при которой у двух таких радикалов будет отобран водород (его унесут специальные молекулы-переносчики), а свободные валентности атомов серы замкнутся друг на друга и образуют между остатками цистеина связь –S–S–. Это называется дисульфидным мостиком (см. рис. 3.4А). Белок вполне может быть в нескольких местах “сшит” такими мостиками (см. рис. 3.4Б). Причем реакция их образования обратима: дисульфидные мостики могут возникать и рваться, и это бывает важно для регуляции некоторых физиологических процессов.
Связи и уровни
Для удобства принято выделять четыре уровня структуры белка. Они так и называются: первичная структура, вторичная, третичная и четвертичная.
Первичная структура — это просто последовательность аминокислот, соединенных пептидными связями (см. рис. 3.4Б). Она всегда линейна, ибо белки не ветвятся. Перечислять аминокислоты в белке принято от N-конца (свободная аминогруппа) к C-концу (свободная карбоксильная группа). Множество таких перечислений, то есть записей первичной структуры белков, есть в современных электронных базах данных, доступных в сети. Можно сказать, что первичная структура белка одномерна, в то время как все остальные уровни — трехмерны. К первичной структуре относятся только пептидные связи, а к остальным уровням — любые другие взаимодействия между аминокислотами, входящими в один и тот же белок.
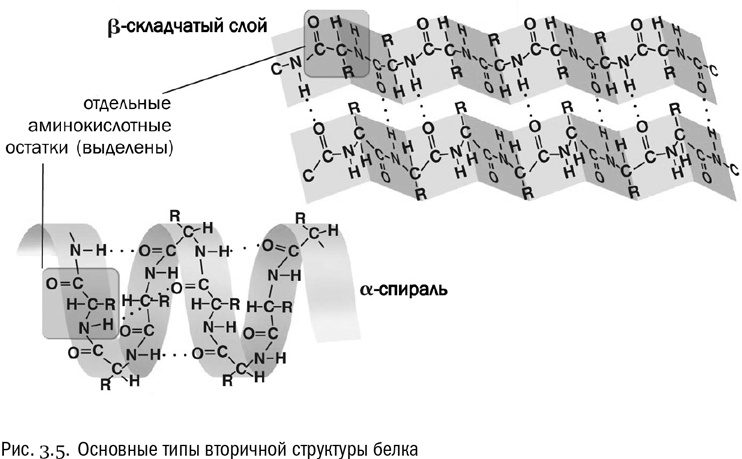
Вторичная структура — это система взаимодействий между аминокислотами в составе одной и той же полипептидной цепочки, расположенными близко (через считаные остатки друг от друга). Вторичная структура держится в основном на водородных связях (см. рис. 3.5). Причем в данном случае это связи между пептидными группами, а не боковыми цепями. А поскольку все пептидные группы одинаковы, то вторичная структура обладает высокой регулярностью, в ней часто повторяется один и тот же “узор”.
Два самых распространенных типа вторичной структуры белка — альфа-спираль и бета-слой. В альфа-спирали водородные связи постоянно образуются между аминокислотными остатками с номерами n и (n+4), то есть каждая аминокислота образует водородную связь с аминокислотой, четвертой по счету от нее. В результате получается компактная спираль, внутри которой находятся пептидные группы, а радикалы торчат в стороны. Альфа-спираль очень устойчива, в том числе и потому, что внутри нее в образовании водородных связей принимают участие все пептидные группы без исключения. В бета-слое полипептидная цепочка несколько раз перегибается, и водородные связи образуются между ее противоположно направленными отрезками.
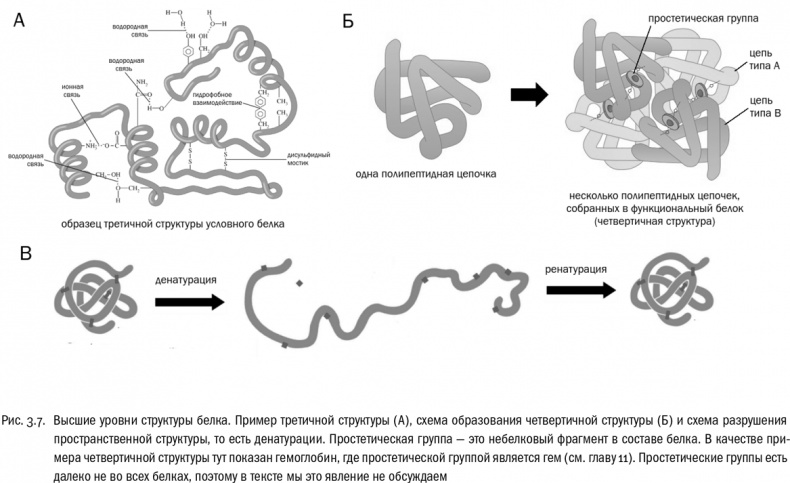
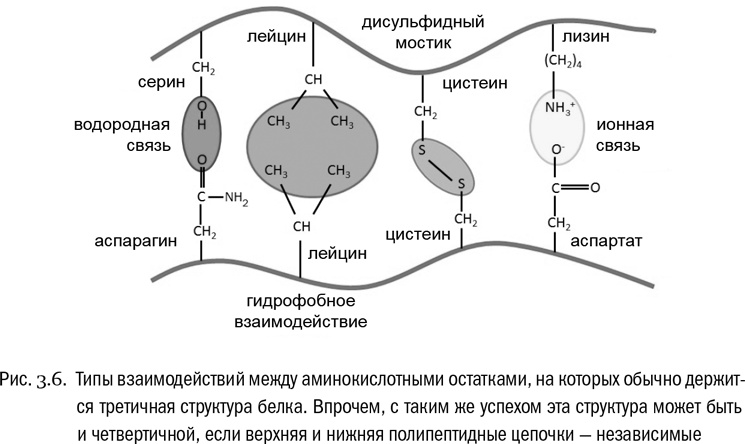
Третичная структура белка — это система взаимодействий между сколь угодно далекими (но принадлежащими к одной и той же полипептидной цепи) остатками аминокислот (см. рис. 3.6, 3.7А). Она определяет, какую форму будет иметь молекула белка целиком. Если вторичная структура — это ближний порядок, то третичная — дальний порядок. В образовании третичной структуры участвуют водородные связи между боковыми цепями, гидрофобные взаимодействия (очень частый случай) и ионные связи между заряженными боковыми цепями. И дисульфидные мостики тоже вносят в третичную структуру свой вклад.
Наконец, четвертичная структура возникает в том случае, если функциональный белок собирается из нескольких отдельных полипептидных цепей (см. рис. 3.7Б). Если белок состоит из одной полипептидной цепи, значит, четвертичной структуры у него нет. Взаимодействия, создающие четвертичную структуру, те же самые, что и в третичной структуре, только не внутри одной полипептидной цепи, а между разными цепями.
Типичный белок с четвертичной структурой — гемоглобин, переносящий кислород в нашей крови. Его молекула состоит из четырех полипептидных цепочек, которые синтезируются отдельно, но свою функцию выполняют только вместе. Объединяются они в основном за счет гидрофобных взаимодействий. Всего молекула нормального гемоглобина взрослого человека включает 574 аминокислоты.
Потеря белком своей пространственной структуры без разрушения пептидных связей (то есть первичной структуры) называется денатурацией, что буквально значит “потеря природы” (см. рис. 3.7В). Самый простой способ денатурировать белок — как следует нагреть его. Именно частичная денатурация белков является основной целью любой тепловой обработки пищи. Причем иногда этот процесс до некоторой степени обратим (при кипячении молока, например). Восстановление пространственной структуры денатурированного белка называется ренатурацией. Но бывает и необратимая денатурация. Например, белок крутого яйца после полной необратимой денатурации растворенных там молекул белков становится твердым, потому что раскрученные полипептидные цепочки перепутываются между собой. Денатурация большинства белков (но не всех!) происходит при температуре 40–50 °С. Это определяет верхний температурный предел для жизни большинства земных живых существ.
Чтобы белок выполнял свою биологическую функцию, нужна, как правило, тончайшая и очень точная “настройка” его пространственной структуры. Нарушения аминокислотной последовательности тем и опасны, что они эту структуру разрушают. Например, существует генетическое нарушение, при котором в строго определенной точке одной из цепей гемоглобина глутамат заменяется на валин. Казалось бы, всего лишь одна аминокислота заменяется на другую. Но здесь это имеет неожиданно серьезные последствия. Глутамат — аминокислота, боковая цепь которой несет отрицательный заряд, валин же нейтрален и гидрофобен. Если рядом окажутся два остатки глутамата, они будут отталкиваться. А если два остатка валина, то, наоборот, слипаться. В данном случае замена глутамата на валин приводит к тому, что слипаться начинают целые молекулы гемоглобина. А это деформирует красные кровяные клетки, в которых он содержится, и вызывает тяжелую болезнь — серповидноклеточную анемию. Именно таков ее молекулярный механизм.