Одиночные, двойные и тройные связи
В главе 11, обсуждая связывание на основе положения атома в Периодической таблице, мы воспользовались представлением о том, что атом стремится сформировать ковалентные связи таким образом, чтобы совместное использование электронов позволяло ему достичь конфигурации благородного газа. Для обсуждаемых здесь элементов второй строки Периодической таблицы — азота, кислорода и фтора — таким благородным газом является неон. Как уже говорилось, атом фтора, который на один электрон отстаёт от конфигурации атома неона, будет совместно с другим атомом использовать один электрон. Атом кислорода, на два элемента отстающий от конфигурации атома неона, будет использовать два электрона, а атом азота, которому до неона не хватает трёх электронов, будет совместно использовать три электрона.
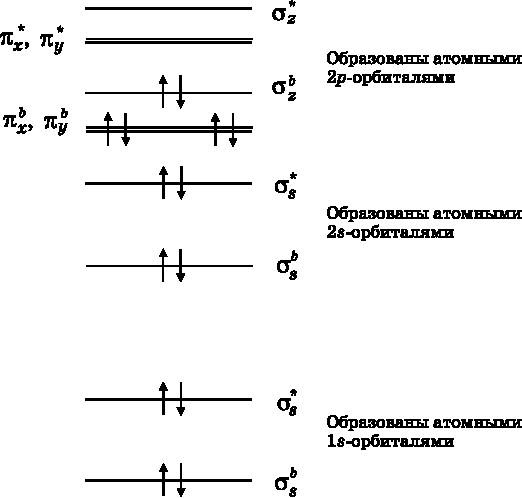
Рис. 13.9.Диаграмма энергетических уровней МО для молекулы N2. Имеется одна дополнительная пара σ-связывающих электронов и две дополнительные пары π-связывающих электронов. N2 имеет тройную связь
Здесь мы увидели, что F2 образует одиночную связь, O2 — двойную связь, а N2 — тройную. Одиночный, двойной или тройной тип связи между атомами обозначают F−F, O=O и N≡N соответственно. О связи между атомами принято думать как о совместно используемых электронах. Ковалентная связь — это связь, образованная совместным использованием пары электронов. Двойная связь — это совместное использование двух пар электронов, тройная — трёх пар. Когда связывающие МО в точности компенсируются разрыхляющими МО, электроны в действительности не используются атомами совместно. Они находятся на молекулярных орбиталях, но связывающие МО порождают конструктивную интерференцию волн амплитуды вероятности, а разрыхляющие МО — деструктивную интерференцию и гасят друг друга. Электроны в этом случае называются неподелёнными парами. Эти пары электронов не дают вклада в связывание. Только одиночная связь, то есть совместно используемая пара электронов в молекуле F2, обеспечивает каждому из атомов F дополнительный электрон, необходимый им для достижения конфигурации атома Ne. В молекуле O2 двойная связь (совместное использование двух пар электронов) обеспечивает по два дополнительных электрона каждому атому O, что позволяет им достичь конфигурации атома Ne. В молекуле N2 тройная связь (совместное использование трёх пар электронов) обеспечивает три дополнительных электрона каждому атому азота, наделяя их конфигурацией атома Ne.
В последовательности молекул F2, O2 и N2 мы обнаружили одиночную, двойную и тройную связи. Совместное использование электронов даёт каждому атому конфигурацию как у атома Ne. Следующий элемент, находящийся слева от азота в Периодической таблице, — это углерод. Можно было бы предположить, что углерод будет формировать четверную связь, чтобы образовать молекулу C2 и достичь конфигурации атома Ne. Однако C2 не существует как стабильная молекула. Причину этого можно понять, если обратиться к рис. 13.9, где приведена диаграмма MO для N2, и удалить два электрона с наибольшей энергией, то есть со связывающей МО σzb. Это дало бы электронную конфигурацию молекулы C2. Однако она имела бы не четверную, а двойную связь, образованную четырьмя электронами, находящимися на двух связывающих π-МО. Наличие только двух связей означает, что атомы углерода в молекуле C2 получили бы за счёт совместного использования только по два, а не по четыре электрона, которые нужны каждому из них, чтобы достичь конфигурации атома Ne. Для достижения этой конфигурации углероду нужно образовать четыре связи, как, например, в молекуле CH4. Он не может образовать четыре связи в молекуле C2, и поэтому такой молекулы не существует
.
Молекула F2 имеет одиночную связь, O2 — двойную связь, N2 — тройную. Из табл. 13.1 видно, что порядок связи сильно влияет на её свойства. Чем больше порядок, тем меньше длина и выше энергия химической связи. Энергия связи — это та энергия, которую нужно передать в молекуле, чтобы разрушить связь. Разрушение связи означает разведение атомов на такое расстояние, на котором они перестают чувствовать друг друга. В следующей главе будет показано, что углерод может создавать одиночные, двойные и тройные связи с другим атомом углерода, если одновременно он образует связи с другими атомами, такими как атом водорода. Однако, прежде чем переходить к обсуждению молекул крупнее двухатомных, необходимо выйти за пределы гомонуклеарных двухатомных молекул и познакомиться с гетеронуклеарными двухатомными молекулами, чтобы понять, как молекулярные орбитали формируются неодинаковыми атомами.
Таблица 13.1.
Влияние порядка связи на её свойства
Молекула: Порядок связи; Длина связи; Энергия связи
F2: 1; 1,42Å; 2,6∙10−19Дж
O2: 2; 1,21Å; 8,3∙10−19Дж
N2: 3; 1,10Å; 15,6∙10−19Дж
Гетеронуклеарные двухатомные молекулы
В гомонуклеарных двухатомных молекулах МО образуются из атомных орбиталей с одинаковой энергией. В гетеронуклеарных двухатомных молекулах, например в молекуле фтороводорода (HF), два атома различаются. Поскольку атомы различны, энергия атомных орбиталей одного атома не совпадает с энергией атомных орбиталей другого. В молекуле HF атом водорода имеет один электрон на 1s-орбитали. Атом F имеет девять электронов на орбиталях 1s, 2s и 2p. Молекулы F2 и H2 имеют одиночные связи. На рис. 13.6 видно, что одиночная связь в F2 — это σ-связь, возникшая за счёт связывающей МО σzb. Эта связывающая МО формируется двумя атомными 2pz-орбиталями, по одной у каждого атома F. Молекула H2 имеет одну σ-связь за счёт связывающей МО, образованной двумя 1s-орбиталями (см. рис. 12.7). При образовании молекулы HF встаёт вопрос о том, какая орбиталь F будет объединяться с 1s-орбиталью H для получения МО, обеспечивающей связывание. Расчёты, проведённые в соответствии с квантовой теорией, показывают, что близкие по энергии состояния (атомные орбитали) могут объединяться и порождать МО с совместным использованием электронов. Атомные орбитали с сильно различающимися по энергии состояниями образуют МО, которые, по сути, эквивалентны атомным орбиталям и не дают вклада в связывание.
Энергия 1s-орбитали атома водорода равна −2,2∙10−18 Дж. (Напомним, знак «минус» означает, что электрон находится в связанном состоянии.) Энергия 1s-орбитали атома фтора (измеренная в молекуле F2) составляет −1,1∙10−16 Дж. Таким образом, 1s-орбиталь атома F примерно в 50 раз ниже по энергии, чем 1s-орбиталь атома H. Это колоссальная разница в энергии, так что 1s-орбиталь водорода не будет образовывать МО с 1s-орбиталью фтора. Для сравнения: энергия 2p-орбитали фтора, которая составляет −2,8∙10−18 Дж, примерно на 25 % ниже энергии 1s-орбитали водорода, так что 2p-орбиталь фтора и 1s-орбиталь водорода достаточно близки по энергии, чтобы образовать полноценные МО.

