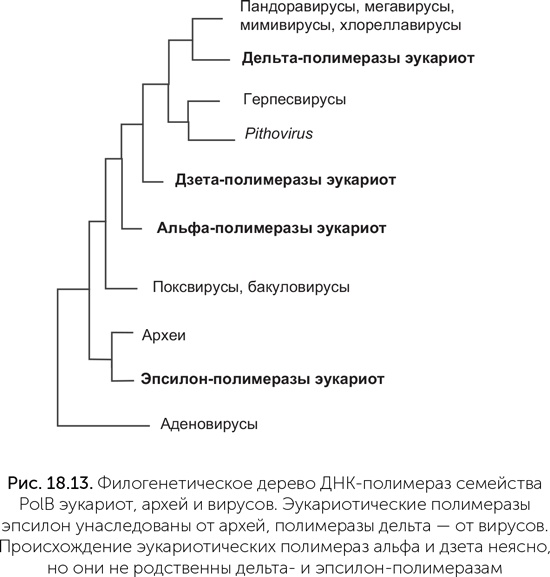
Наконец, Патрик Фортерр связал с вирусами происхождение огромного количества эукариотических белков, которые не похожи ни на какие белки бактерий и архей (Forterre, 2011). По последним оценкам, общий предок современных линий эукариот уже имел более 1400 таких белков. Среди них преобладают вспомогательные белки цитоскелета и ДНК-связывающие белки, в структуре которых присутствуют многочисленные короткие повторы. Вирусы, особенно крупные, содержат много генов, не похожих ни на какие гены клеточных организмов, а часто и на гены других вирусов. Кодируемые ими белки тоже часто имеют множественные короткие повторы. Низкая точность вирусных полимераз, интенсивная рекомбинация и «гонка вооружений» с хозяевами приводят к очень быстрой эволюции вирусных белков по сравнению с клеточными, поэтому вирусы – обильный источник принципиально новых белков.
Вирусная теория происхождения ядра и полового размножения
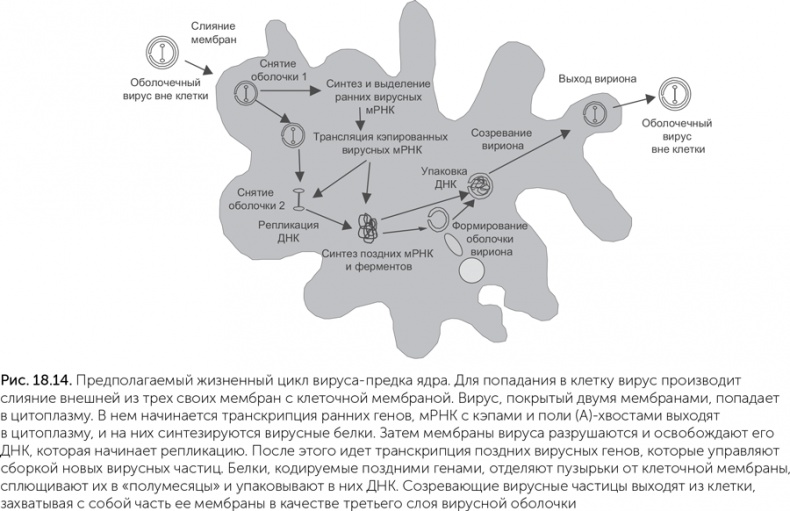
К крупным ДНК-вирусам (LNCDV, Large Nucleo-Cytoplasmic DNA Viruses) относятся, например, поксвирусы (из них широко известен возбудитель оспы), мимивирусы (недавно открытая группа гигантских вирусов-паразитов амеб) и фикоднавирусы, поражающие водоросли. Они имеют крупную и сложную вирусную частицу, покрытую несколькими мембранами. Самая внешняя мембрана сливается с наружной мембраной клетки при заражении, и в цитоплазму попадает вирус, окруженный двумя внутренними мембранами. Эти мембраны местами сливаются между собой, образуя некое подобие ядерных пор. Они выстланы изнутри белками капсида (вирусной оболочки), аналогичными белкам ядерной оболочки. В такой форме вирус долго существует в цитоплазме, в нем происходят транскрипция, кэпирование и полиаденилирование РНК, экспорт зрелых РНК в цитоплазму через поры вирусной частицы. Вирусы оспы раньше называли «мини-ядрами», а вирион мимивируса по размеру почти не уступает ядру клетки-хозяина.
Сходство крупных ДНК-вирусов с ядром эукариот наблюдается по многим признакам:
• генетический материал ограничен двумя липидными мембранами с белковым каркасом между ними;
• транскрипция и трансляция разделены в пространстве (транскрипция идет внутри вируса, трансляция – в цитоплазме клетки-хозяина);
• мРНК активно экспортируется через поры в мембранной оболочке;
• геном состоит из линейных молекул ДНК с тандемными повторами на концах;
• расхождение дочерних молекул ДНК при делении может сопровождаться исчезновением оболочки.
Геном таких вирусов представлен линейной двухцепочечной ДНК длиной до 200 000 пар нуклеотидов у поксвирусов и более 1 млн – у мимивирусов, что сравнимо с размером самых малых бактериальных геномов. Открытые в 2013 году пандоравирусы имеют геном размером до 2,5 млн пар нуклеотидов, что соответствует среднему геному свободноживущей бактерии. Для репликации ДНК эти вирусы разбирают вирусную частицу (она называется «вирион»). По мере накопления вирусной ДНК в цитоплазме клетки собираются новые вирионы, которые окружаются впячиваниями эндоплазматического ретикулума и плазматической мембраны. Кэпирование, полиаденилирование, а часто и подготовка дезоксирибонуклеотидов при размножении этих вирусов осуществляют их собственные ферменты, без участия клеточных белков.
По предложенному Беллом сценарию вирус, ставший предком ядра, паразитировал на метаногенной архее с клетками разветвленной формы, не имевшей клеточной стенки (Bell, 2006). Такие археи есть и сейчас, например, Methanoplasma elizabethii; разветвленная форма позволяет им плотнее контактировать с выделяющими водород бактериями-ацетогенами. Как и у многих современных крупных ДНК-вирусов, зрелые частицы этого вируса были покрыты тремя мембранами. Внешняя из трех мембран сливалась с наружной мембраной заражаемой клетки, а две внутренние имели поры, пропускавшие РНК и другие молекулы из вируса в цитоплазму клетки и обратно. Такие оболочки современных вирусов строятся из мембран эндоплазматического ретикулума клетки-хозяина, а у археи, не имевшей внутренних мембран, для их построения использовалась внешняя мембрана клетки. От мембраны клетки-хозяина «отшнуровывались» круглые пузырьки, которые затем складывались в двухслойное полушарие, окружали новые копии вирусной ДНК и выходили из клетки, покрываясь при этом третьей мембраной (рис. 18.14). Подобным образом одеваются мембранами частицы бактериофага PRD1, и в его случае все манипуляции с мембранами производят только вирусные белки.
Ключевым моментом превращения вируса в ядро должен был стать, как мы уже упоминали, переход такого вируса в лизогенное состояние. Многие вирусы способны переключаться между литическим жизненным циклом (быстрое размножение с гибелью клеток хозяина) и лизогенным существованием – скрытой инфекцией, практически не влияющей на жизнеспособность хозяина. Лизогенное состояние достигается двумя способами: можно вставить свой геном в геном хозяина и пользоваться хозяйскими системами репликации или же, переключив активность вирусных генов, постоянно существовать в цитоплазме. В этом случае вирус временно превращается в плазмиду – автономную молекулу ДНК. Он тоже может пользоваться хозяйской системой репликации, но ему нужны собственные механизмы контроля количества копий. Если он будет отставать в репликации от генома хозяина, то деления хозяина будут часто порождать незараженные клетки, а если репликация вируса будет слишком активной, то он будет снижать жизнеспособность хозяина.
Большинство лизогенных бактериофагов и крупные плазмиды поддерживают минимальное число своих копий и используют специальную систему разделения копий по дочерним клеткам, похожую на ту, которая разделяет хромосомы в клетках современных эукариот. Эта система обычно включает в себя белок, способный собираться в нити, специальные участки ДНК (центромеры) и второй белок, связывающий центромеры с нитями первого белка. Центромеры – это части молекулы ДНК (хромосомы или плазмиды), которые не содержат генов и состоят из многочисленных коротких повторов. К ним прикрепляются нити веретена деления и через них же соединяются сестринские хромосомы до того, как разойтись по разным клеткам. В расхождении хромосом при делении клеток животных, которое описано во вставке в начале этой главы, веретено деления имеет два центра организации на полюсах, и хромосомы растаскиваются к этим полюсам. Гораздо более простые системы разделения копий плазмид имеют один центр организации веретена – соединенные центромеры двух копий плазмиды. Короткие нити веретена прикрепляются одним концом к одной копии плазмиды, другим – к другой. Удлинение нитей толкает две копии плазмиды в разные стороны. У ряда одноклеточных эукариот (эвглены, динофлагелляты и др.) при митозе ядерная оболочка сохраняется, веретено деления образуется внутри ядра, а механизм движения хромосом похож на таковой у плазмид.
У некоторых плазмид, например R1, белок нитей похож на актин, у других встречаются родственники тубулина. Плазмиды, не способные образовывать вирусные частицы, имеют другой путь заражения новых клеток – конъюгацию, т. е. образование специальных контактов между бактериальными клетками, по которым передается плазмидная ДНК.

