Ферменты сульфатного дыхания дают примеры более сложных структур. Например, комплекс Qmo, проводящий электроны к аденозил-фосфосульфат-редуктазе (Apr), занимается сведением в один ток электронов от хинона и ферредоксина. В его составе есть цитохром b, дикубановая субъединица и две флавин-содержащие субъединицы. Комплекс DsrMKJOP, восстанавливающий переносчик серы DsrC, состоит обычно из пяти субъединиц: каталитической гетеродисульфид-редуктазной, двух мембранных хинонных портов (цитохром b и PsrC/NrfD типа) и двух вспомогательных на наружной стороне мембраны (трехгемовый цитохром с и тетракубановая). Зачем такая сложность – непонятно, потому что в некоторых клетках с той же работой справляется комплекс DsrMK из двух субъединиц – одной каталитической и одного цитохрома b. В группе дельта-протеобактерий ферменты сульфатного дыхания и другие комплексы еще более усложнены и содержат по несколько субъединиц цитохромов с, которые могут иметь до четырех-шести гемов. Видимо, это позволяет им быстро переключаться между разными окислителями и восстановителями.
Происхождение комплекса I (НАДН-хинон-оксидоредуктаза)
Один из сложнейших комплексов дыхательной цепи митохондрий и многих бактерий, комплекс I, переносит электроны с НАДН на хиноны. Энергия этих электронов используется для откачки из клетки протонов, которые затем входят обратно через роторную АТФазу и производят АТФ. У архей Methanosarcinales есть родственные комплексы, переносящие электроны с водорастворимого кофермента F420 на мембранный аналог хинона, метанофеназин. Минимальный вариант комплекса I включает в себя 14 разных субъединиц. В митохондриях животных комплекс I еще более сложен, и количество его субъединиц может превышать 40. Комплекс I по форме похож на букву Г, одно плечо которой лежит в мембране, а другое выступает в цитоплазму. Сайт связывания НАДН находится на конце цитоплазматического плеча. Четыре из мембранных субъединиц (J, L, M, N) непосредственно переносят протоны через мембрану за счет изменения формы белка (рис. 17.8).
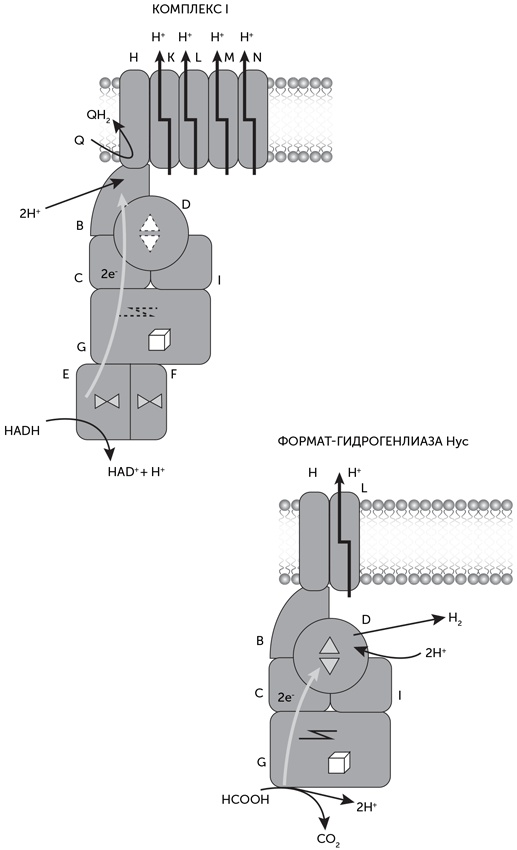
Сравнение аминокислотных последовательностей субъединиц комплекса I показало, что у многих из них есть родственники в других типах белков, прежде всего среди гидрогеназ и натрий-протонных антипортеров
[19]. Гидрогеназы – это разнообразная группа ферментов, работающих с молекулярным водородом. Они могут как вырабатывать водород, окисляя НАДН, ферредоксин и другие переносчики электронов, так и поглощать водород с восстановлением переносчиков. Эти функции востребованы, например, у организмов, использующих молекулярный водород для получения энергии и восстановления СО2 (ацетогены, метаногены и многие другие). По используемым металлам в активном центре гидрогеназы делятся на NiFe и FeFe семейства, которые дальше подразделяются на группы по составу субъединиц. Родством с комплексом I обладает четвертая группа NiFe гидрогеназ.
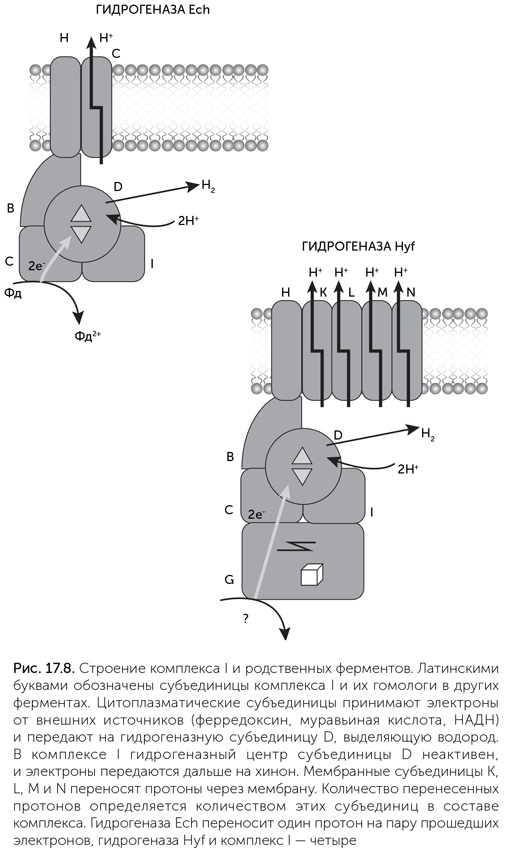
В четвертой группе гидрогеназ наиболее просто устроены гидрогеназы Ech. Это мембранные ферменты, получающие электроны от цитоплазматических доноров и выделяющие водород. Они состоят из шести субъединиц, все они имеют гомологи в комплексе I. Четыре цитоплазматических субъединицы гидрогеназы Ech родственны субъединицам B, C, D, I комплекса I, а две мембранных – субъединицам H и L соответственно (рис. 17.8). Каталитический центр гидрогеназы Ech, содержащий по одному атому железа и никеля, расположен на гомологе D-субъединицы комплекса I.
Более сложные гидрогеназы этой группы имеют дополнительные субъединицы. Например, Hyc – формат-гидроген-лиаза кишечной палочки – осуществляет разложение муравьиной кислоты с выделением СО2 и водорода. Она состоит из восьми субъединиц, шесть из которых похожи на субъединицы Ech, а две другие – молибден-содержащая формат-дегидрогеназа и субъединица, участвующая в передаче электронов от молибденового центра к никель-железному. Эти две субъединицы гомологичны, соответственно, С– и N-концам субъединицы G комплекса I. Гидрогеназа Hyf, тоже обнаруженная у кишечной палочки, имеет также гомологи мембранных субъединиц K, M, N комплекса I, которые ответственны за перенос протонов через мембрану. К сожалению, источник электронов для Hyf пока не найден. У других бактерий и архей обнаружены гидрогеназы четвертой группы, содержащие до 13 субъединиц и способные переносить ионы через мембраны. Для некоторых из них известны доноры электронов. Например, гидрогеназа Coo бактерий Rhodospirillum и Carboxydothermus окисляет угарный газ с выделением водорода и запасанием энергии.
Известны также близкородственные гидрогеназам белки, не имеющие собственно гидрогеназного центра. Наиболее просто устроены комплексы Ehr, состоящие из двух цитоплазматических субъединиц (гомологи B и D комплекса I) и четырех находящихся в мембране, которые соответствуют субъединицам H, L, M и С-концу K в составе комплекса I. Их функции неизвестны. Более сложный гидрогеназоподобный комплекс Mbx архей Pyrococcus и Thermococcus содержит также гомологи субъединиц C и I и дополнительные мембранные субъединицы. Он переносит электроны с ферредоксина на НАДФ и сопрягает эту реакцию с переносом протонов через мембрану.
Субъединицы L, M и N комплекса I ответственны за транспорт ионов. Помимо гидрогеназ четвертой группы родственные им белки входят в состав натрий-протонных антипортеров. Эти мембранные транспортные белки обменивают один ион натрия на один протон, перенося их через мембрану навстречу друг другу, и могут работать в обоих направлениях. Перенос ионов происходит благодаря движениям всей белковой молекулы. Эти антипортеры используются для соединения натриевой и протонной энергетики в одной клетке и могли быть одной из первых систем откачки протонов из клетки на заре протонной энергетики. Детальное изучение трехмерной структуры комплекса I показало, что субъединица H обладает сходной пространственной укладкой с L, M и N, но у нее отсутствуют аминокислоты, необходимые для связывания ионов. Видимо, она, подобно L, M и N, тоже происходит от натрий-протонных антипортеров, но в составе комплекса I изменила функцию и участвует в передаче движения от цитоплазматического плеча «рычага» к ионным насосам L – M-N.
Мы видим, что шире всего распространены четыре субъединицы: мембранные H и L и цитоплазматические B и D. Они присутствуют в комплексе I, во всех мембранных гидрогеназах и гидрогеназоподобных комплексах, например Ehr. Поскольку они всегда оказываются в середине ферментных комплексов, их еще называют «универсальным адаптером». Субъединицы B и D также родственны двум субъединицам растворимых NiFe-гидрогеназ. Видимо, движение электронов в этих гидрогеназах сопровождалось изменением формы белка, и соединение B-D субъединиц с мембранными H-L, происходящими от натрий-протонного антипортера, позволило гидрогеназе запасать энергию, перенося ионы через мембрану.




