Хотя полной стерилизации поверхности Земли при поздней метеоритной бомбардировке не произошло, организмы, предпочитающие умеренные температуры до 50 °C (они называются мезофилы, в отличие от термофилов, живущих при 50–80 °C, и гипертермофилов, способных жить в кипятке), вряд ли выжили. После окончания бомбардировки холодные места обитания были вновь заселены потомками термофилов.
В нескольких очень интересных исследованиях (например, Akanuma et al., 2013) были сделаны попытки реконструировать последовательности отдельных ферментов LUCA. В этих работах последовательность предковых белков была вычислена из последовательностей множества их современных потомков как у бактерий, так и у архей; затем были синтезированы гены, кодирующие предковый фермент, встроены в клетки кишечной палочки и использованы для наработки и измерения свойств ферментов LUCA. Всякий раз оказывалось, что оптимальная температура для работы предковых ферментов – примерно 65–80 °C. На родословных деревьях как бактерий, так и архей самые первые ветви состоят из термофилов. Это может быть как отражением термофильности LUCA, так и избирательным выживанием термофилов в эпоху поздней метеоритной бомбардировки. Если она привела к вымиранию всех микробов, кроме термофилов, то в этом случае методы реконструкции предковых последовательностей могут ошибочно приписать термофильность и LUCA.
Удары астероидов выбивают из планет осколки, способные преодолеть притяжение и выйти на околосолнечные орбиты. Более сотни марсианских метеоритов такого происхождения попали в руки ученых. Моделирование судьбы обломков, выбитых из Земли во время поздней метеоритной бомбардировки, показало, что они могут быть дополнительным убежищем для спор микробов. До 30 % выбитых обломков возвращается на Землю в течение 5000 лет после столкновения, и содержащиеся в них споры могут вновь заселить остывшую после удара поверхность планеты (Wells, 2003). Более того, эти обломки имеют шанс перенести жизнь на другие тела Солнечной системы: 0,2 % обломков попадают с Земли на Марс в течение 5 млн лет после столкновения, а самые первые достигают Марса уже через 100 000–150 000 лет. Обратный перенос с Марса на Землю требует больше времени – первые обломки совершают этот путь примерно за 300 000 лет, но зато их количество оказывается в 10 раз больше, чем перенесенных с Земли на Марс. Некоторые из обломков имеют шанс попасть даже на спутники Юпитера после 4 млн лет космического путешествия. Так что вполне возможно, что в ходе глубокого бурения на Марсе мы обнаружим жизнь общего происхождения с нашими земными организмами.
Устройство фотосинтеза современных растений и цианобактерий
Разнообразные реакции хемосинтеза, упомянутые выше, составляют лишь малую долю в энергетическом балансе биосферы. Подавляющее большинство живых организмов на планете зависит от энергии Солнца напрямую, как растения, или косвенно, как животные, получающие от растений пищу и кислород. Большинство бактерий тоже прямо или косвенно зависит от органики растительного происхождения либо от кислорода. Биосфера подключена к природному термоядерному реактору, Солнцу, благодаря фотосинтезу.
Процесс фотосинтеза, как он описан в школьных учебниках, состоит из световых и темновых реакций. Световые реакции сводятся к синтезу АТФ и восстановителей, таких как НАДФН, при помощи света и какого-либо донора электронов. Темновые реакции – это восстановление СО2 при помощи НАДФН и АТФ в цикле Кальвина или, реже, в других реакциях, и они уже обсуждались в главе о происхождении обмена веществ. Темновые реакции не уникальны для фотосинтеза. Тот же цикл Кальвина работает и при хемосинтезе, и свет не принимает участия в его реакциях.
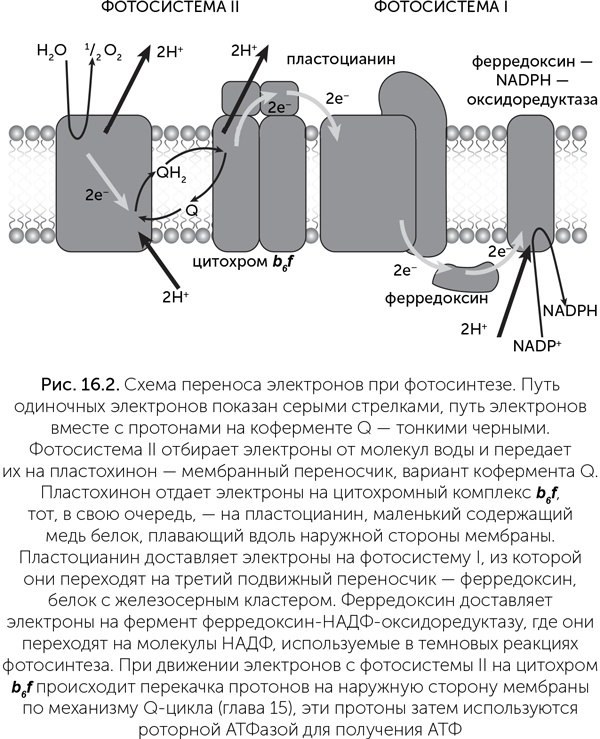
Напомним структуру фотосинтетического аппарата зеленых растений. Его функциональное ядро составляют реакционные центры – встроенные в мембрану белки, с которыми связаны молекулы хлорофилла – по две в каждом реакционном центре и несколько вспомогательных, передающих энергию света в центр. Возбужденные молекулы хлорофилла передают электроны на молекулы-переносчики, и затем они попадают в электрон-транспортную цепь. В отличие от дыхательной цепи, в которой электрический ток создается «химической батареей», полюса которой – НАДН и кислород, здесь электрический ток создают реакционные центры фотосистем, работающие подобно солнечным батареям. Они питают две нагрузки: во-первых, за счет энергии света происходит электролиз воды с выделением кислорода. Во-вторых, как и в дыхательной цепи, ток электронов через механизм Q-цикла преобразуется в ток протонов через мембрану и синтез АТФ на роторной АТФазе. Напряжения, создаваемого одной фотосистемой, недостаточно для электролиза воды, поэтому две фотосистемы соединяются последовательно. Как мы помним, модули электрон-транспортных цепей соединяются подвижными переносчиками электронов, поэтому для последовательного соединения нужны разные типы переносчиков и несовместимые «разъемы» для них.
Реакционные центры делятся на два типа по используемым переносчикам электронов: фотосистемы I типа (ФСI) передают электроны на ферредоксин – маленький водорастворимый белок с железосерным кластером, а фотосистемы II типа (ФСII) – на хиноны, плавающие в мембране. Цианобактерии и хлоропласты растений обладают обоими типами фотосистем, а различные фотосинтезирующие бактерии – только одним типом из двух. Электроны ФСI через ферредоксин переносятся на НАДФ и затем используются в реакциях восстановления разных органических веществ. Электроны ФСII проходят через хиноны на цитохромный комплекс b6f, отдавая часть энергии на протонный ток и синтез АТФ, и далее на ФСI. В цианобактериях и хлоропластах растений окисленная ФСII с помощью водоокисляющего комплекса восполняет недостающие электроны из молекул воды, выделяя кислород. Кроме того, если клетке требуется больше АТФ, возможен циклический транспорт электронов по маршруту ФСII – хинон – цитохром b6f – ФСII (рис. 16.2). Реакционные центры окружены большим количеством вспомогательных антенных белков, также связывающих хлорофилл, которые поглощают световые кванты и передают возбуждение на реакционные центры.
Разнообразие систем, запасающих энергию света
Очевидно, что столь сложная система из хлорофиллов и других пигментов
[16] и электрон-транспортных цепей не могла возникнуть сразу. У нее должны были быть более простые предшественники, а возможно, и альтернативные системы фотосинтеза, не использующие хлорофилл. Как мы помним из предыдущих глав, в состав живых систем с самого начала входили молекулы с особыми отношениями со светом. Например, все азотистые основания эффективно рассеивают энергию ультрафиолетового света в тепло, защищая соседние молекулы. Адениновые нуклеотиды в растворе также способны за счет энергии света присоединять фосфатные группы, синтезируя АТФ. Древние окислительно-восстановительные коферменты, такие как НАД и ФАД, тоже могли пройти отбор на особые фотохимические свойства. Как мы помним из главы про мир РНК-коэнзимов, ФАД (флавинадениндинуклеотид) и в современном мире проводит одну реакцию при помощи энергии света. Это реакция восстановления тиминовых димеров – одного из продуктов повреждения ДНК ультрафиолетом. В ходе экспериментов было обнаружено, что силикатно-протеиноидные микросферы, содержащие флавин, могут за счет энергии света синтезировать АТФ из АДФ и фосфата (рис. 16.3).



