Происхождение мембранных АТФаз
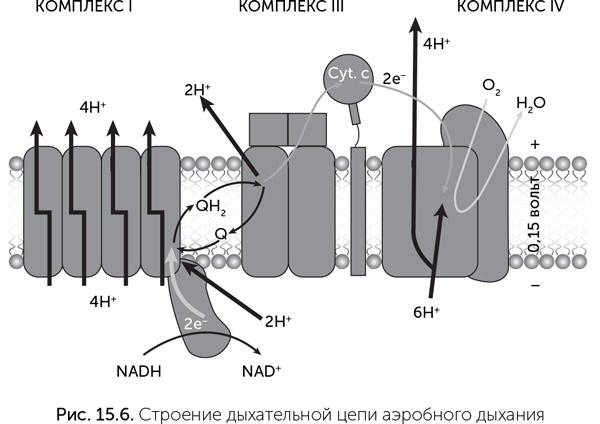
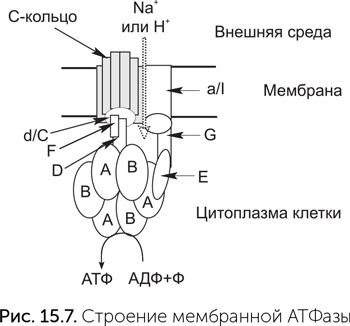
Комплексы дыхательных цепей очень разнообразны, подстраиваются к условиям обитания клетки, и их гены подвержены горизонтальному переносу. Мы обсудим их происхождение в главе 17. Мембранные АТФазы же во всех клетках устроены довольно похоже. Молекулы мембранной АТФазы состоят из вращающейся части («ротор») и неподвижной («статор») (рис. 15.7). «Ротор» состоит из кольца из 8–15 мелких субъединиц С в мембране, центрального стержня из субъединиц D, d/C и F в цитоплазме. В состав статора входят боковой стержень, выступающий в цитоплазму (субъединицы E и G), и кольцо из трех А– и трех В-субъединиц. Центральный стержень ротора входит в кольцо из А и В-субъединиц, и при вращении его конец изгибает и сдвигает субъединицы А и В друг относительно друга.
Подробное видео работы АТФазы можно посмотреть по адресу: http://haa.su/Av9/.
Протоны связываются двумя карманами «статора» – по одному с каждой стороны мембраны, и чтобы пройти мембрану, они должны, связавшись с С-субъединицей, ждать поворота C-кольца на одну субъединицу. Это единственный путь от внутреннего «кармана» статора к наружному. Молекулы ATФ и АДФ связываются между A и В субъединицами цитоплазматического «статора», активный АТФазный центр образуется в контакте со статором. Чтобы из АДФ и фосфата получилась молекула АТФ, нужно движение А-субъединицы относительно соседней В-субъединицы. Это движение обеспечивает ротор за счет энергии проходящих через АТФазу протонов. На один оборот ротора каждый из трех АТФазных центров АВ-кольца создает одну молекулу АТФ. Таким образом, на один оборот молекулы через мембрану переносится от 8 до 15 протонов (по одному на каждую C-субъединицу) и синтезируется три молекулы АТФ.
Важнейшее преимущество такого преобразования энергии состоит в том, что роторная АТФаза позволяет клетке использовать для синтеза АТФ химические реакции, выделяющие мало энергии. Она синтезирует за один оборот три молекулы АТФ, а количество прошедших ионов равно числу С-субъединиц – от 8 до 15. Иначе говоря, на синтез одной молекулы АТФ приходится от трех до пяти прошедших ионов. Роторная АТФаза работает как своего рода повышающий трансформатор: достаточно, чтобы выделяющейся в химической реакции энергии хватило на перенос через мембрану одного протона, дальше из множества этих маленьких порций энергии будет собрано несколько более крупных.
Основные субъединицы АТФазы и их взаимное расположение похожи на систему секреции белков III типа (рис. 15.8). Эта общая для бактерий и архей система активно выделяет белки из клетки, развернув их в цепочку, с затратой АТФ и вращением выделяемого белка. А– и В-субъединицы статора также обладают более далеким, но достоверным сходством с хеликазами семейства Rho и белком RecA. Эти белки образуют кольца из шести одинаковых субъединиц, которые вращаются вокруг ДНК, расплетая ее с затратой АТФ (обсуждалось в главе 14). Таким образом, мембранная АТФаза происходит от древнего семейства вращающихся АТФаз с разнообразными функциями. Вероятно, сначала предковая РНК-хеликаза вступила в контакт с мембранной порой и стала работать системой экспорта РНК из протоклетки. АВ-кольцо, происходящее от хеликазы, не только проталкивало экспортируемую РНК наружу, но и крутило ее. Потом этот белковый комплекс переключился с РНК на белки и дал начало системе секреции белков III типа. Потом секретируемый белок застрял в поре этой системы секреции и стал передавать вращение, создаваемое АВ-кольцом, на С-кольцо. Для возникновения роторной АТФ-синтазы осталось только совместить вращение белка и транспорт ионов через него. В составе С-кольца системы секреции белков III типа уже есть участки связывания ионов натрия, которые помогают скреплению С-субъединиц друг с другом. Мутации бокового стержня статора могли создать проходы для этих ионов к обеим сторонам мембраны и превратить заклинившую систему секреции в роторную АТФазу.
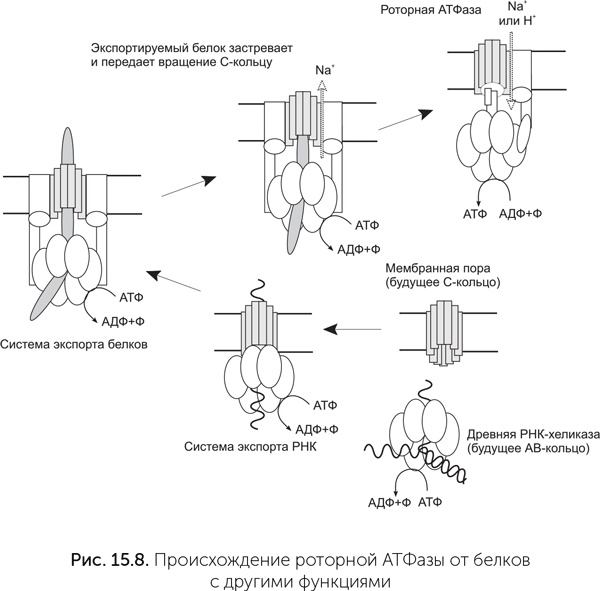
Роторные мембранные АТФазы делятся на два семейства: F и A/V. F-семейство характерно для бактерий, A/V – для архей. У организмов с клеточными ядрами, таких как животные и растения, роторные АТФазы обоих семейств встречаются в разных частях одной клетки. F-АТФазы у них обычно находятся в митохондриях, а A/V – в лизосомах и других однослойных мембранных пузырьках. Два семейства АТФаз похожи по набору субъединиц. Большинство субъединиц АТФазы одного семейства похожи и родственны аналогичным субъединицам другого семейства. Исключением является стержень ротора. Между стержнями F и A/V семейств АТФаз нет ничего общего. Поскольку стержень необходим для передачи вращения между С-кольцом и АВ-кольцом, т. е. для сопряжения ионного транспорта с синтезом АТФ, это означает, что общий предок F и A/V АТФаз мог и не быть ион-движущей АТФазой. Не исключено, что два семейства АТФаз возникли независимо из системы секреции белков, когда выделяемый белок застревал в ней и начинал передавать вращение.
Натриевая и протонная энергетика
У ряда бактерий и архей мембранные АТФазы впускают в клетку не протоны, а ионы натрия. Соответственно, у них комплексы дыхательной цепи откачивают наружу натрий вместо протонов, мембранные транспортеры и жгутики тоже работают на натрии. Первые открытые обладатели натриевой энергетики обитают в экстремальных условиях: при высокой температуре или в сильнощелочной среде, и замена протонов на натрий выглядит хорошей адаптацией к этим условиям. Однако позже были открыты бактерии с натриевой энергетикой в самых разных экологических нишах, включая морскую воду и кишечник животных. Некоторые бактерии имеют и натриевую, и протонную АТФазу, два типа комплексов электрон-транспортной цепи и в разных условиях могут переключаться между натриевой и протонной энергетикой.
На филогенетическом дереве АТФаз оказывается, что натрий-специфические ферменты занимают самые нижние ветви в обоих семействах, что указывает на их древность.
Второй аргумент в пользу древности натриевой энергетики – устройство ион-связывающих сайтов С-субъединиц. Каждый натриевый сайт образован пятью аминокислотами, атомы кислорода которых точно окружают ион натрия, заменяя молекулы воды в его гидратной оболочке. Протонные сайты же устроены очень по-разному и похожи на поврежденные мутациями варианты натриевого сайта. Причем варианты протонных сайтов хорошо согласуются с отдельными ветвями протонных АТФаз на дереве (Mulkidjanian et al., 2008).
Третий аргумент вытекает из гипотезы происхождения АТФазы на базе системы секреции. Мембранные С-субъединицы системы секреции тоже связаны друг с другом ионами натрия.
Четвертый аргумент связан с мембранными липидами. Дело в том, что мембраны из описанных в начале главы липидов, как у бактерий, так и у архей, не способны удерживать протонный градиент; протоны просачиваются через них, рассеивая энергию в тепло. Зато такие мембраны вполне герметичны для ионов натрия. Чтобы сделать мембраны герметичными для протонов, бактерии и археи добавляют в них разные специальные липиды (рис. 15.9) (Haines, 2001).





