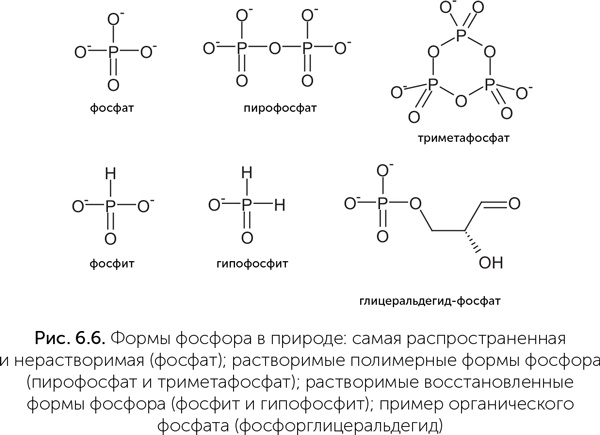
Как же собрать в колыбели жизни достаточно фосфора, причем в форме, пригодной для получения сахарофосфатов и нуклеотидов? В принципе, возможно несколько решений (рис. 6.6). Например, пирофосфат (P2O74−) растворим в воде в присутствии кальция и магния и, более того, способен служить источником энергии для биохимических реакций, подобно АТФ. Некоторые микроорганизмы и сейчас используют пирофосфат для тех реакций, которые у других организмов требуют затрат АТФ. Другая растворимая и химически активная форма фосфора – фосфит (HPO32−). Это соединение может окисляться до фосфата с выделением большого количества энергии и давно используется химиками для синтеза искусственной ДНК (Lestinger et al., 1975). Кроме того, многие бактерии обладают ферментами для окисления фосфита и могут использовать его как единственный источник фосфора. Некоторые бактерии даже способны получать энергию из процесса окисления фосфита.
Где и как могли накопиться пирофосфаты или фосфиты в высоких концентрациях? Хорошим источником могут быть метеориты. В двух типах метеоритов (состоящие из железа и силикатов энстатитовые хондриты и железные метеориты) содержится до 0,1–0,5 % минерала шрайберзита (фосфид железа Fe3P). При попадании в воду шрайберзит постепенно разлагается, выделяя фосфиты, фосфаты, пирофосфаты, оксид железа и водород. До 50 % фосфора из шрайберзита переходит в фосфиты и до 5 % – в пирофосфаты. Фосфит устойчив к ультрафиолетовому излучению, не окисляется в отсутствии катализаторов и может сохраняться в морской воде сотни миллионов лет (Pasek et al., 2008).
Другой источник фосфитов и пирофосфатов – вулканы и связанные с ними наземные геотермальные источники. Измерения японских геохимиков на вулкане Усу (остров Хоккайдо) показали, что в выходящих из фумарол вулканических газах с температурой 540–700 °C содержится заметное количество летучих оксидов фосфора: P4O10, PO2 и P4O6. При лабораторном моделировании поведения жидкой лавы при температуре 1300 °C оказалось, что до 40 % фосфора из нее улетучивается в виде оксидов (Yamagata et al., 1991). Последующее растворение этих оксидов в воде дает фосфиты и пирофосфаты.
Вода многих наземных геотермальных источников обогащена соединениями фосфора: например, в грязевых котлах Мутновской сопки на Камчатке его концентрация достигает 0,01 % (Bortnikova et al., 2009). В большинстве геохимических анализов геотермальной воды измерялся общий уровень фосфора во всех формах, не различая фосфат, пирофосфат и фосфит, но для горячих источников Мамонтовых озер в Калифорнии показано, что до половины фосфора в их воде содержится в виде фосфита (Pech et al., 2009). В древних вулканических газах и геотермальных водах, скорее всего, содержание всех форм фосфора было еще в несколько раз выше, потому что древнейшие материки, как мы помним из главы 4, были сложены богатыми фосфором KREEP-базальтами.
Еще один механизм накопления фосфора связан с уже упомянутыми кристаллами сульфида цинка. Как мы помним, на свету эти кристаллы постепенно разрушаются. В качестве подходящего восстановителя для предохранения ZnS от фотокоррозии, как оказалось, идеально подходят восстановленные формы фосфора – фосфиты и гипофосфиты (H2PO2−). В присутствии фосфитов ZnS проводит восстановление CO2, сопряженное с окислением фосфита до фосфата. Более того, значительная часть этого фосфата соединяется с прилипшими к кристаллу органическими молекулами, образуя фосфорилированные сахара и кислоты, как в клетках. Это один из возможных путей накопления фосфорилированной органики в местах зарождения жизни.
Наземные геотермальные поля – колыбель жизни?
Поиск местообитаний, богатых переходными металлами и фосфором, ведет нас к горячим источникам вблизи вулканов. Как мы помним, еще одна особенность минерального состава клеток – это высокая концентрация калия и малая – натрия. В морской воде соотношение этих металлов обратное. Если фосфор и соли переходных металлов в принципе могут накапливаться в высыхающих водоемах любого типа, то соотношение калий-натрий не меняется при высыхании и поэтому является самым надежным признаком возможной колыбели жизни.
Геотермальные воды горячих источников разных типов сильно отличаются друг от друга по соотношению калия и натрия, среди них есть похожие в этом отношении как на морскую воду, так и на клетки. Горячие источники обычно питаются водой с поверхности – дождевой, снеговой или речной, так называемыми метеорными водами. Метеорные воды стекают по трещинам и сквозь поры вглубь земной коры, ближе к магматическому очагу, там нагреваются и частично растворяют горные породы. Поднимаясь снова к поверхности, горячая вода закипает по мере снижения давления. Чаще всего пар выходит из земли по трещинам прямо над магматическим очагом, и такие выходы называются фумаролами. Жидкая вода, которая не успела выкипеть, тоже поднимается по трещинам и выходит на поверхность горячими источниками. Типичное геотермальное поле, например, Лардерелло в Италии, состоит из множества фумарол в середине и горячих источников по краям.
В холодном и влажном климате (Камчатка, Исландия, Йеллоустоун, Новая Зеландия) встречается еще два типа горячих источников – гейзеры и грязевые котлы. Гейзер периодически выбрасывает струю горячей воды под давлением, а в остальное время из него идет пар. Если пар охлаждается не текущей сверху холодной водой, а холодным воздухом на поверхности, то он конденсируется, и получаются грязевые котлы. Их грязь состоит из мельчайших частиц глины, которые образуются из поднимающихся с паром летучих силикатов.
В совместной работе Армен Мулкиджанян и вулканолог Андрей Бычков (2012) показали, что из всех типов водоемов и горячих источников именно грязевые котлы лучше всего подходят на роль колыбели жизни. Как известно геологам, при кипении горячей минеральной воды, особенно при температурах выше 100 °C (под давлением), происходит разделение растворенных веществ. Одна их часть остается в жидкости и выходит в горячих источниках, а другая испаряется вместе с водой и выходит через фумаролы и грязевые котлы. Понятно, что с паром вырываются прежде всего вулканические газы, которые были растворены в воде (H2S, CO2, NH3, HCN), но также в пар переходят оксиды фосфора, силикаты и соли некоторых металлов, прежде всего калия, цинка и марганца (рис. 6.7)! За счет разделения ионов металлов при кипении пар, поднимающийся от магматического очага, содержит много калия и мало натрия, как цитоплазма клеток. Такой же минеральный состав имеет и жидкость грязевых котлов, образуемая при охлаждении и конденсации этого пара. Иными словами, жидкость грязевых котлов – это наиболее похожая на цитоплазму клеток природная среда. Вода геотермальных источников, которая не выкипела под землей, а поднималась на поверхность в жидком виде, наоборот, обогащена нелетучими солями – хлоридами натрия и железа.
Грязевые котлы обогащены именно теми элементами, которые накапливают клетки: калием, фосфором, азотом (в виде аммиака) и микроэлементами: цинком, марганцем, молибденом и бором (в следующей главе мы увидим, что молибден и бор очень важны для появления РНК). Натрия в них немного, и соотношение калий/натрий получается близким к внутриклеточной среде. Правда, современные грязевые котлы содержат много серной кислоты, которая получается при реакции сероводорода с кислородом воздуха, и практически необитаемы. Но в древние эпохи, когда кислорода в атмосфере еще не было, грязевые котлы должны были иметь нейтральную среду и быть пригодными для жизни. В нейтральной среде силикаты должны были осаждаться не в виде жидкой глины, а в виде цеолитов и других твердых пористых силикатных минералов с огромной поверхностью. Ионы цинка и марганца в сероводородной воде должны были осаждаться в виде сульфидов, причем для такого способа накопления ZnS и MnS даже не требуется повышенное атмосферное давление.

