Во всем мире насчитываются миллионы людей, ослепших из-за разрушения светочувствительных клеток сетчатки, так называемых фоторецепторов. Джералд Чейдер, глазной врач из Лос-Анджелеса, сообщил об исследованиях трех полностью слепых пациентов. От миниатюрной камеры в очках информация посылалась в миниприемник, имплантированный в сетчатку. Микропроцессор преобразовывал зрительные сигналы в электрические. 16 электродов были соединены с нижними нервными клетками сетчатки, которые еще были активны и передавали информацию по глазному нерву дальше в мозг. После длительной тренировки пациенты могли различать крупные предметы (голову или тарелку). Число электродов шаг за шагом увеличивают до 1000, так что через 5-10 лет уже можно будет различать лица. Другая группа исследователей информацию от миниатюрной камеры посылает для электронной обработки в прибор, который пациент носит в брючном кармане. Оттуда информация передается к приемнику, который соединен с многочисленными микроэлектродами, имплантированными в зрительную кору больших полушарий (рис. 21).
Исходя из электрической активности множества управляющих моторикой клеток коры головного мозга, становится всё более возможно делать заключение об их намерениях и тем самым управлять, например, рукою-роботом. Это позволяет надеяться, что в будущем от паралича можно будет успешно избавиться. Опыты на животных показали, что при параличе, при отсутствии управления со стороны мозга, возможно выработать динамический стереотип для ходьбы с помощью электростимуляции спинного мозга, трехмесячной тренировки и медикаментозной поддержки. Грегуар Куртин из Цюриха рассчитывает, что в течение ближайших пяти лет сможет применить эту технику на парализованных пациентах. Впечатляющий результат был достигнут у 25-летнего Мэтью Нейгла, который был полностью парализован после удара ножом в шею. Ему имплантировали в моторную область коры пластинку величиной 4x4 мм с 96 электродами (рис. 21). Электрической активности клеток мозга, управляющих моторикой, оказалось достаточно, чтобы работать с компьютером. Он за несколько минут научился этому после того, как его попросили представить себе, что он двигает рукой, чтобы управлять курсором на экране компьютера. Ему удалось также, только силой воображения, нарисовать круг на экране, читать электронную почту, играть в компьютерные игры и даже сжимать и разжимать пальцы протеза руки. Эксперимент выявил не только возможности такого нейропротеза, но и его границы. Нейгл еще до операции мог управлять компьютером с помощью голоса. После операции он был привязан к большому компьютеру, и при нем всегда находился ассистент для поддержки. Из-за всего этого добавочная ценность электродов в мозге была не столь уж и велика. Когда по прошествии девяти месяцев электрический сигнал из мозга ослаб, он попросил удалить электроды. Здесь еще много чего нужно улучшить, но в этой области всё время появляются новые многообещающие разработки.
XII.6 Трансплантация зародышевой мозговой ткани
Если трансплантация зародышевой мозговой ткани прошла успешно, какие свойства могут быть приобретены от донора?
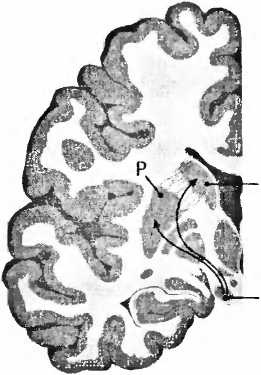
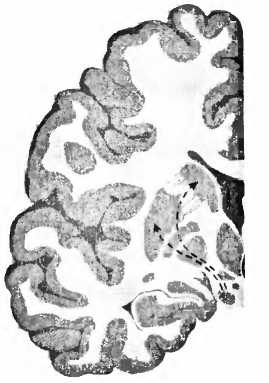
Для болезни Паркинсона характерно отмирание дофаминовых клеток в черной субстанции (substantia nigra) мозгового ствола (рис. 23). При вскрытии эта область мозга из-за пигментации клеток, вырабатывающих дофамин, выглядит как проходящая через мозговую ткань черная лента. И если эти клетки мертвы, их сразу же видно, как, например, при болезни Паркинсона. Тогда клетки не могут больше иннервировать полосатое тело (стриатум), моторную область в центре мозга, то есть снабжать ее нервными волокнами и управлять ею. Из-за недостатка в стриатуме дофамина возникают типичные для этой болезни расстройства движения. Что может быть логичнее, чем лечить эту болезнь заменой умерших клеток? В1987 году в ведущем профессиональном журнале The New England Journal of Medicine
[89] появилась статья мексиканского врача Мадрасо, в которой он сообщал о поразительном улучшении у больного паркинсонизмом после аутотрансплантации ткани дофаминсодержащих клеток надпочечников в хвостатое ядро (nucleus caudatus, рис. 23). В ближайшие два года сообщение привело к лавине из 200 подобных трансплантаций. Но операция оказалась неэффективной, и в течение двух лет после нее 20 % пациентов умерли. Исследование мозга умерших показало, что трансплантированная из надпочечников ткань в мозге не прижилась. В стриатуме были видны только шрамы. Многообещающие результаты Мадрасо были основаны, вероятно, на непрофессионально проведенных исследованиях в сочетании с эффектом плацебо (см. XVII.4).
С 1988 года больным паркинсонизмом вместо аутотрансплантации в стриатум ткани надпочечников производят пересадку дофаминсодержащих клеток фетального мозга. Для достижения эффекта ткань должна быть взята у плода возрастом от 6 до 8 недель. Позитронно-эмиссионная томография показала, что при жизни наличие трансплантата можно было установить в мозге примерно 85 % прооперированных пациентов. В стриатуме мозга скончавшегося пациента дофаминсодержащие клетки, связанные с клетками мозга реципиента, были найдены через 16 лет после операции. Но иногда всё же новые дофаминовые клетки также перенимают симптомы болезни Паркинсона. Тот факт, что болезнь иногда переходит на трансплантат, является, возможно, причиной последующего ухудшения состояния пациентов, которые сначала выиграли от операции. Для имплантации необходим материал от четырех эмбрионов. Получить такой материал нелегко, поскольку источником его служит аборт, причем должно быть получено предварительное согласие женщины на трансплантацию. Поэтому сейчас возлагают большие надежды на эмбриональные стволовые клетки как альтернативный источник для трансплантации, так как при их выращивании можно дифференцировать дофаминовые нейроны. В настоящее время, впрочем, эта терапия обладает многими недостатками и таит в себе немало опасностей. Зафиксирован случай, когда у больного через 4 года после инъекции стволовых клеток в мозжечок образовалась опухоль мозга. Из стволовых клеток в принципе может вырасти что угодно, в том числе и опухоль.
NCSN норма
болезнь Паркинсона
Рис. 23. При болезни Паркинсона пигментированные черным клетки, производящие дофамин в черной субстанции (SN), умирают и уже больше не могут управлять моторной областью — полосатым телом стриатумом (Р — putamen, скорлупа; NC — nucleus caudatus, хвостатое ядро).
Трансплантация зародышевых дофаминовых клеток в мозг больных паркинсонизмом может иметь определенный успех, так как тогда их лекарство, леводопа, требуется им в меньшем количестве, и к тому же двигательные расстройства снижаются. 11о об окончательном выздоровлении речь не идет, и результаты варьируются. Кроме того, и позитивное воздействие, и побочные эффекты трансплантации те же, что и у леводопы. Примерно в 15 % случаев осложнения при трансплантации проявляются в виде нарушений движений (дискинезии), что возникает также и при приеме леводопы. Проводились плацебо-контролируемые исследования, когда половина пациентов (которые не знали, к какой именно группе они относятся), хотя и были оперированы, не получили трансплантата. Через два года, в том, что касается двигательных расстройств, не было никакой разницы между мнимо оперированными пациентами и пациентами с трансплантатом. В итоге убедительных результатов до сих пор не имеется (см. XVII.4).





