Возникновение сложного механизма трансляции путем случайного дрейфа также не реалистично — во всяком случае, в рамках стандартных представлений эволюционной биологии (см. обсуждение в конце этой главы). Таким образом, единственный возможный путь для появления трансляции, по-видимому, экзаптация: промежуточные этапы эволюции трансляционной системы должны быть отобраны для иных функций, нежели синтез белка. Различные сценарии возникновения трансляции исходят из различных предположений о природе экзаптируемых функций.
Простая и потенциально плодотворная идея состоит в том, что в мире РНК аминокислоты и пептиды функционировали в качестве кофакторов рибозимов. Сатмари первым разработал гипотезу, основанную на этом предположении, и предложил, что «кодирующие коферментные олигонуклеотиды» (ККО; олигонуклеотиды-рибозимы с различными каталитическими активностями, использующие аминокислоты в качестве кофакторов) могли быть эволюционными предшественниками тРНК (Szathmary, 1993, 1999). Предполагается, что ККО собирались с участием содержащихся в них протоантикодонов на эволюционных предшественниках мРНК, однако детали этой стадии остаются неясными. Гипотеза ККО связывается с представлением о том, что тРНК возникла в ходе эволюции в результате двух последовательных дупликаций связывающих аминокислоты шпилек. Вариант гипотезы ККО, предложенный Р. Найтом и Л. Ландвебер, включает эволюцию аминоацилирующих рибозимов (возможность, хорошо подтверждаемая экспериментальными данными, см. табл. 12-1) и возникновение безматричного, опосредованного рибозимами синтеза пептидов в качестве промежуточного этапа эволюции трансляции (Knight and Landweber, 2000).
Майкл Ярус (Yarus, 1998) предложил модель прямого связывания РНК в качестве альтернативы ККО как сценария происхождения трансляции. Согласно этой модели, изначальной формой взаимодействия аминокислот и прото-тРНК было непосредственное связывание, предположительно через кодонные триплеты. Затем непосредственное связывание вытеснилось адапторным механизмом, вероятно, при участии аминоацилирующих рибозимов, как в варианте ККО Найта—Ландвебер.
Взяв за основу гипотезу ККО, мы с Юрием Вольфом разработали обобщенную, но детализированную модель возникновения трансляционной системы в мире РНК (Wolf and Koonin, 2007). Эта модель включает в себя как дарвиновский отбор, так и аспекты конструктивной нейтральной эволюции (см. гл. 8), наряду с экзаптацией и субфункционализацией.
Отправной точкой всех сценариев происхождения трансляции является реплицирующийся ансамбль эгоистичных кооператоров, состоящий из молекул РНК с различными рибозимными активностями и существующий в сети неорганических ячеек (см. дальнейшее обсуждение в следующем разделе). Эти рибозимы исполняют, в числе прочих функций, и функцию репликазы; вероятно, представлены и другие функции, такие, например, как синтез предшественников РНК. Наш эволюционный сценарий включает в себя следующие этапы (см. рис. 12-4).
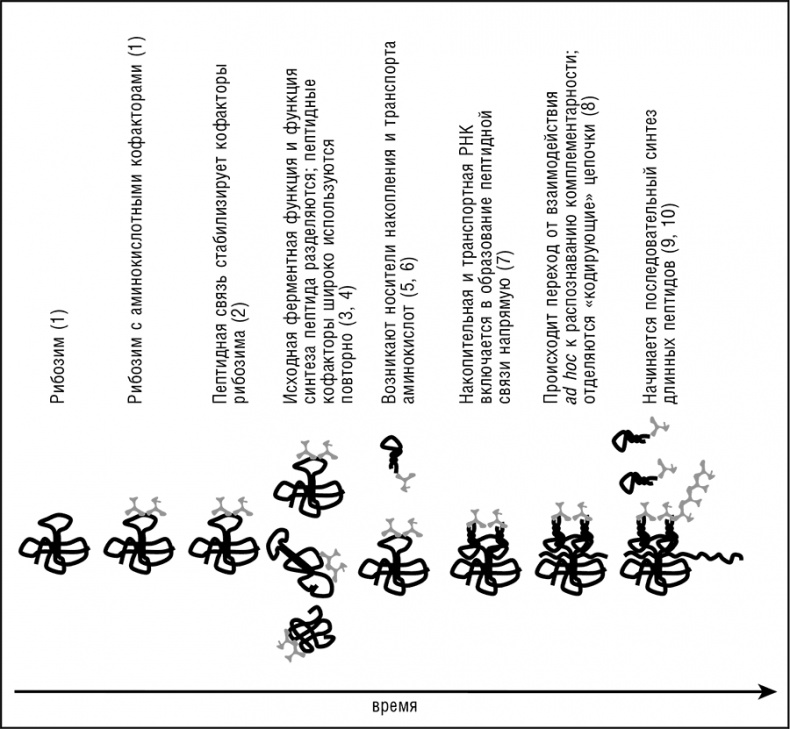
Рис. 12-4. Концептуальный сценарий происхождения трансляционной системы посредством экзаптации и субфункционализации. Шаги модели, описанные в тексте, обозначены цифрами в скобках.
1. Рибозим R является частью ансамбля эгоистичных кооператоров в ячейке. Этот рибозим достаточно сложен для катализа реакции (X → Y), скорость которой влияет на приспособленность ансамбля, и имеет определенное число позиций, способных к эволюции, так что возможна эволюция новых функций. Две или более абиогенных аминокислоты, присутствующие в ячейке, связываются с R. Избирательное связывание аминокислот обеспечивается активным центром, случайно присутствующим в R. Участие стереохимического протокода (кодон/антикодон) на данном этапе возможно, но не повлияет на ситуацию существенным образом. Присоединенные аминокислоты стимулирует реакцию X → Y, катализируемую R. In vitro были получены рибозимы, сильно стимулируемые пептидами что дает экспериментальное обоснование этому принципиальному шагу (Robertson et al., 2004). В контексте эгоистично-кооперативной эволюции (см. гл. 11) естественный отбор будет отбирать аминокислоты, стимулируемые R, приводя к постепенному совершенствованию пространственного выравнивания аминокислот на R и отбору последовательности и структуры оптимальных для связывания аминокислот.
2. R приобретает дополнительную активность лигазы пептидной связи, формируя олигопептид P из соседних аминокислот, связанных с R. Отбором in vitro были получены рибозимы с высокой активностью пептидной лигазы, хотя и с низкой избирательностью. По-видимому, рибозимы этого класса способны синтезировать только короткие пептиды, состоящие из, самое большее, четырех или пяти аминокислот. Селекционным преимуществом этого новоприобретения будет повышение стабильности реактивного комплекса, приводящее к дальнейшему усилению реакции X → Y. Естественно задаться вопросом, откуда на этом шаге берется энергия, необходимая для формирования пептидной связи. В экспериментально описанных рибозимных пептидных лигазах один из субстратов является активированным производным (аминоацил-аденилат), так что используется энергия эфирной связи. Это напоминает современную трансляцию, в которой АРСазы используют аминоацил-аденилаты для аминоацилирования специфической тРНК, а высокоэнергетичная эфирная связь аминоацил-тРНК используется для транспептидации. Гипотетические древнейшие пептид-лигазы, возможно, действовали таким же образом, используя аминоацил-аденилаты или другие активированные производные аминокислот, произведенные другими рибозимами. И действительно, были получены рибозимы, катализирующие каждую из этих реакций, от аденилирования аминокислот до синтеза пептидов (см. табл. 12-1). Эти рибозимы, несомненно, зависят от энергии фосфодиэфирной связи в АТФ или иной формы энергии.
3. Спонтанная диссоциация или распад R высвобождает пептид P обратно в ячейку. Если P обладает неспецифической способностью стимулировать и (или) стабилизировать рибозимы, он может быть захвачен другим рибозимом E, катализирующим другую реакцию (U → V). Интересным примером мог бы быть пептид, содержащий пару отрицательно заряженных аминокислот и образующий комплекс с двухвалентным катионом, аналогично разнообразным, неродственным современным ферментам метаболизма нуклеиновых кислот (полимеразы, нуклеазы, лигазы, топоизомеразы, и др.). Если P повышает каталитическую активность E, он снова увеличивает приспособленность всего ансамбля.
4. В то время как активность E по-прежнему зависит от наличия P, копия R (RL) может потерять исходную функцию катализа X → Y при сопутствующем усилении функции аминокислотной лигазы, в то время как другая копия (R0) сохраняет исходную функцию, все еще усиливаемую пептидом Р. Заметим, что это типичная субфункционализация, основной путь эволюции дуплицированных генов в современных геномах (см. гл. 8). Субфункционализация, возможно, была важна уже в мире РНК, когда выгода усиленного катализа R0 и Е перевешивала увеличение затрат на репликацию.



