Это может показаться сильным доводом против гипотезы о значимости замены Ц на Т, но ситуация не настолько очевидна. У членов семьи, где наблюдается голопрозэнцефалия, часто проявляются немалые различия в симптомах, даже если вызвавшая их мутация затронула сам морфогенный ген. До 30% членов семей, где наблюдается такая мутация, не демонстрируют вообще никаких симптомов данной болезни, а у остальных симптомы могут быть весьма различны в зависимости от конкретного больного. Первая ситуация называется вариабельным проникновением, а вторая — вариабельной экспрессивностью.
К сожалению, это классические примеры того, как биологи идентифицируют явление, дают ему красивое название и перестают о нем думать. Да, ученые описали наблюдаемые явления при помощи тех фраз, которые приведены выше. Только вот пока не очень-то понятно, почему это происходит. В этой удивительной сфере мы пока еще разбираемся слабо. Возможно, существуют другие тонкие геномные вариации, компенсирующие у некоторых людей влияние таких изменений ДНК. Возможно, при таких вариациях активизируются другие энхансеры, тем самым резко усиливая экспрессию морфогена. Возможно, у некоторых людей происходит и своего рода эпигенетическая компенсация, как бы подталкивающая экспрессию ключевых генов в нужном направлении. А возможно, речь идет о комбинации перечисленных факторов — и других, которые мы пока не выявили.
Однако если мы имеем дело с неопределенной ситуацией такого рода (один из родителей и ребенок имеют одно и то же генетическое изменение, но проявляют разные симптомы), жизненно необходимо выстроить дополнительные линии доводов в поддержку любой гипотезы, касающейся влияния такой замены нуклеотидного основания. Исследователи, выявившие замену Ц на Т в энхансере, именно это и проделали. Они проверили эффект замены на мышах. Удалось показать: когда Ц находится в упомянутом положении, соответствующий участок мусорной ДНК действует как энхансер экспрессии морфогена. Но когда на смену Ц приходит Т, эта область больше не действует как энхансер, и содержание данного морфогена в мозгу так и не достигает нужного уровня.
Морфогены и поджелудочная железа
Участие морфогена в формировании лишних пальцев или в развитии всевозможных форм голопрозэнцефалии — не единственный пример, когда причиной какого-то заболевания человека становится изменение в регуляторной области ДНК. Вот, к примеру, панкреатический агенез — болезнь, при которой поджелудочная железа развивается неправильно. У детей, родившихся с этим заболеванием, часто наблюдаются острые формы диабета7. Дело в том, что именно поджелудочная железа вырабатывает инсулин — гормон, позволяющий нашему организму регулировать уровень сахара в крови.
В большинстве семей, где наблюдается панкреатический агенез, отмечается мутация одного определенного транскрипционного фактора
[47],8, но у некоторого количества таких семей мутирует другой транскрипционный фактор
[48],9. Однако известно много случаев, когда ребенок рождается с необъяснимым панкреатическим агенезом (то есть никого среди его родных это заболевание не коснулось). Как правило, мы считаем, что такие ситуации возникают случайно: может быть, вследствие какого-то нарушения развития, вызванного реакцией организма на воздействие не опознанного нами фактора среды. Но постепенно стало очевидно, что большинство таких ситуаций (казавшихся спорадическими) возникает в семьях, где родители больного ребенка являлись родственниками друг друга (обычно — двоюродным братом и сестрой). Значит, мы имеем дело с близкородственным браком и так называемым генетическим родством. Когда генетическое родство связано с повышенным уровнем заболеваемости наследственными недугами, мы обычно ищем какое-то генетическое изменение, причем такое, при котором обе копии хромосомы несут на себе одну и ту же вариацию. Причины, по которым такие заболевания более распространены у детей, рожденных в близкородственном браке, схематически показаны на рис. 15.1.
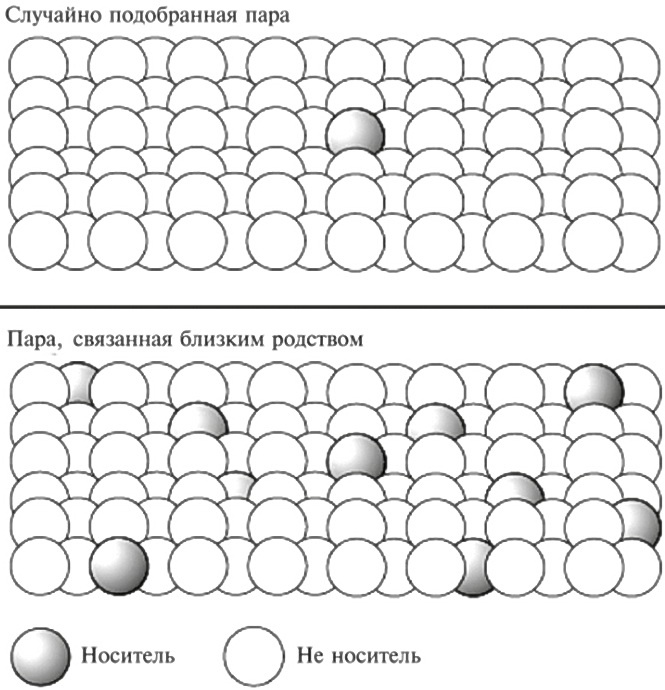
Рис. 15.1. Вверху показано, что для носителя редкой генетической мутации сравнительно мала (со статистической точки зрения) вероятность встретить другого носителя такой же мутации среди населения в целом. Однако в собственной семье куда вероятнее повстречать человека, который тоже унаследовал эту мутацию (ситуация проиллюстрирована внизу). Вот почему редкие рецессивные заболевания (такие, при которых каждый из родителей является бессимптомным носителем одного мутантного гена) встречаются чаще, когда родители пациента — близкие родственники (скажем, двоюродные брат и сестра).
Исследователи выделили ДНК пациентов со спорадической формой панкреатического агенеза и проанализировали все области, кодирующие белки. Им не удалось отыскать вариации в ДНК-последовательности, которые послужили бы объяснением данного заболевания. Поэтому они обратились к предсказанным регуляторным областям. Мы уже знаем, что таких областей в человеческом геноме несметное количество. Чтобы сузить зону поисков, ученые решили выяснить, что происходит, когда культивируемые в лаборатории стволовые клетки превращаются при дифференциации в клетки поджелудочной железы. Исследователям хотелось найти регуляторные области, которые несут в себе эпигенетические модификации, обычно ассоциируемые с функционированием энхансеров, а, кроме того, связывающие транскрипционные факторы, которые (как удалось предварительно установить) играют важную роль в развитии клеток поджелудочной железы.
Это сузило список участков-кандидатов всего до 6 тысяч с небольшим. Такое количество куда легче подвергнуть углубленному анализу. Оказалось, что у 4 пациентов А меняется на Г в предполагаемом энхансере — области из примерно 400 пар нуклеотидных оснований, располагающейся на хромосоме 10. Эта область размещается в 25 тысячах парах нуклеотидных оснований от одного из транскрипционных факторов, который (как опять-таки предварительно установили) мутирует у небольшой доли семей, страдающих панкреатическим агенезом. У 7 из 10 пациентов, не связанных близким родством, наблюдалось одно и то же изменение: энхансер на обеих копиях хромосомы 10 имел основание Г там, где обычно располагается основание А. При этом у восьмого и девятого пациентов мутации располагались поблизости от этого места, а десятый вообще, как выяснилось, утратил этот энхансер. Проанализировали также геном приблизительно 400 человек, которых не коснулось данное заболевание. Ни у кого из них не обнаружилось такой замены А на Г.
Исследователи показали, что область, которую они выявили, действует как энхансер в развивающихся панкреатических клетках — и что данная область перестает служить энхансером, когда в определенной позиции основание А в ней меняется на основание Г. Затем, в ходе дальнейших экспериментов, они стали изучать, как данный энхансер влияет на свой ген-мишень. Это влияние схематически показано на рис. 15.2. ДНК-последова-тельность образует петлю, тем самым приближая энхансер к гену-мишени. Обычно этот энхансер соединяется с транскрипционными факторами, которые помогают включать ген-мишень. Но транскрипционные факторы связываются лишь с определенными ДНК-последовательностями. Когда основание А меняется на основание Г, транскрипционные факторы не могут соединяться с этим участком, а значит, не могут и включать ген-мишень10.



