В 1949 году, оканчивая фундаментальный курс естественных наук и только начиная учиться медицине, Эллисон принял участие в экспедиции на гору Кения, организованной Оксфордским университетом. Однокурсники Эллисона больше интересовались местными растениями и насекомыми, а сам он собирал образцы крови представителей различных племен по всей территории страны для определения группы крови и других исследований.
Одной из важнейших задач было выявление случаев серповидно-клеточной анемии. Эта болезнь, открытая в 1910 г., получила свое название от серповидной формы эритроцитов в крови у больных людей (рис. 7.2).
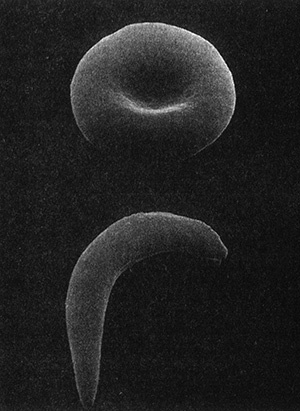
Рис. 7.2. Нормальный и серповидный эритроциты. Аномальная форма эритроцитов объясняется нарушением структуры гемоглобина. Фотография любезно предоставлена Джеймсом Уайтом (медицинский факультет Университета Миннесоты).
Было известно, что эта болезнь имеет рецессивный характер наследования; клетки индивидов, имеющих одну копию мутированного гена (таких людей называют носителями), принимали серповидную форму лишь при определенных условиях, тогда как в крови у людей с двумя мутированными версиями гена всегда содержались аномальные эритроциты, и эти люди были больны. 1949 год стал переломным для понимания причин серповидно-клеточной анемии. Известный биохимик Лайнус Полинг и его научная группа обнаружили, что в эритроцитах больных серповидно-клеточной анемией содержится аномальный гемоглобин (белок, переносящий кислород).
В том же году во время экспедиции Эллисон обнаружил, что наличие в крови серповидных эритроцитов было весьма неравномерно распределено у представителей различных племен. Вблизи озера Виктория и на побережье Индийского океана серповидные эритроциты были обнаружены у 20 % населения. В высокогорных или засушливых районах серповидные эритроциты встречались не более чем у 1 % населения. Эллисон стал размышлять над этими наблюдениями. Почему, если серповидно-клеточная анемия является такой серьезной болезнью, аномальные эритроциты встречаются так часто? И почему представители одних племен поражены этим недугом сильнее, чем представители других?
Эллисону пришла в голову удивительная и по-настоящему блестящая идея. Он подумал, что широкое распространение серповидных эритроцитов может быть связано с устойчивостью к малярии. Эллисон знал, что малярия и переносящие ее комары гораздо чаще встречаются во влажных низинах, чем в высокогорье, где практически нет источников пресной воды.
Свою идею он смог проверить лишь через несколько лет, когда получил медицинское образование. В 1953 году он продемонстрировал, что носители гена серповидно-клеточной анемии имеют определенную устойчивость против малярии, а дети с серповидными эритроцитами имеют в крови меньше возбудителей малярии, чем дети с нормальным гемоглобином. Эллисон обследовал около 5 тыс. жителей Восточной Африки и установил, что там, где распространена малярия, до 40 % популяции могут быть носителями серповидных эритроцитов, в то время как в свободных от малярии районах уровень распространения этого признака низок. Эллисон составил карту, которая демонстрировала соответствие между распространением серповидных эритроцитов и малярии на территории Африки (рис. 7.3).
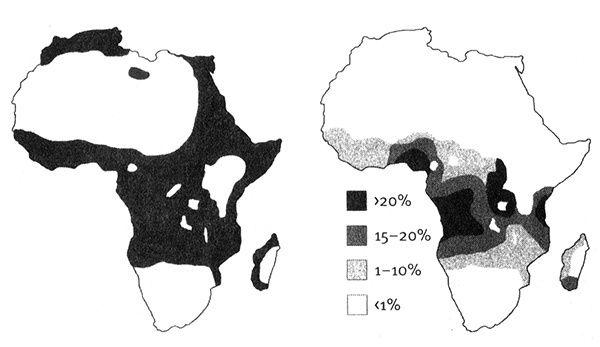
Рис. 7.3. Распространение серповидно-клеточной анемии и малярии. Карты показывают соответствие между распространением серповидных эритроцитов (справа) и малярийных комаров (слева). Рисунок Лианн Олдс на основании статьи A. C. Allison (2004), Genetics 166:1591.
Обнаруженный эффект не зависел от племенных и языковых различий и показывал, что малярия оказала глубокое воздействие на генетику человека. Эволюция гена серповидно-клеточной анемии — классический пример действия естественного отбора в человеческой популяции. Удивительно, однако, что в большинстве учебников ничего не сообщается об Эллисоне и его идее о том, что малярия была движущим фактором естественного отбора (см. список литературы).
За 50 лет, прошедших со времен пионерских исследований Эллисона, появилось много новых доказательств того, что малярия оставила в геноме человека весьма заметный след. Серповидно-клеточная анемия распространена не только в регионах к югу от Сахары, но спорадически возникает также в Греции и Индии. Шестьдесят процентов людей, живущих в районе озера Копаис в центральной части Греции, а также 32 % населения полуострова Халкидики на севере страны являются носителями гена серповидно-клеточной анемии. Тридцать процентов коренного населения региона Нилгири на юге Индии также несут в себе этот ген. Что общего между этими районами? До недавнего времени, пока не были приняты меры по борьбе с малярией, эти районы отличались высоким уровнем распространения этой инфекции.
Еще более очевидное доказательство этой связи состоит в том, что мутация, которая приводит к появлению серповидных эритроцитов и заключается в точечной замене в шестом триплете соответствующего гена (GAG меняется на GTG), возникала в человеческих популяциях не менее пяти раз: у народа банту, в Бенине, Сенегале и Камеруне, а также в Индии (рис. 7.4). Здесь на примере нашего с вами вида мы снова наблюдаем, как эволюция в точности воспроизводит сама себя.
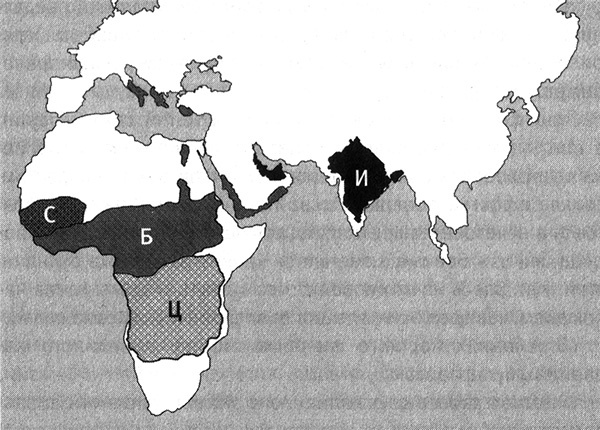
Рис. 7.4. Мутация, приводящая к образованию серповидных эритроцитов, возникала в человеческой популяции несколько раз. На карте показаны пять регионов (Сенегал (С), Бенин (Б), Центральноафриканская республика (Ц), юг Европы и Индийский полуостров (И)), где возникала одна и та же мутация и откуда она распространилась по другим регионам. Рисунок Лианн Олдс.
В условиях жесткого давления отбора, вызванного малярийным паразитом, мутация, которая опасна для жизни, если присутствует в двух копиях гена, может сохранить жизнь, если присутствует только в одной копии гена. Именно по этой причине «плохие» копии отдельных генов могут сохраняться в популяции.
Аномальный гемоглобин из серповидных эритроцитов — не единственный пример. Фермент, который сокращенно называют G6PD
[17], играет ключевую роль в метаболизме глюкозы и поддержании окислительно-восстановительного баланса внутриклеточной среды. Недостаток этого фермента — наиболее распространенный вариант ферментативной недостаточности, от которой страдают примерно 400 млн человек во всем мире. В разных человеческих популяциях обнаружены 34 различные мутации G6PD, встречающиеся с разной частотой. Хотите знать, где проживают эти популяции?
Если вы скажете, что в малярийных районах, будете совершенно правы! Невозможно представить, что распространение этих вариантов гена в малярийных районах и их отсутствие в тех районах, где малярии нет, является простым совпадением. Действительно, в организме людей с дефицитом G6PD малярийный паразит размножается слабее, чем у людей с нормальной формой фермента. Широкое эпидемиологическое исследование с участием 2000 африканских детей показало, что недостаточность G6PD снижает вероятность заболевания тяжелой формой малярии на 46–58 %. Кроме того, было показано, что в клетках с низким уровнем G6PD рост паразита заторможен. По-видимому, изменение окислительного состояния внутриклеточной среды эритроцитов с недостатком G6PD нарушает жизненный цикл паразита.





