Rb – не единственный опухолевый супрессор, уже выявлено около 70 таких генов. Кроме того, мутации Rb связаны не только с ретинобластомой, они встречаются и при других видах рака, например при остеосаркоме и раке легких.
Более того, Rb может выключаться не только в результате мутаций. Работа белка Rb регулируется добавлением фосфатных групп, за что отвечают протеинкиназы. Rb тем активнее, чем меньше он фосфорилирован, а при высокой фосфорилированности он перестает работать. Прямое или косвенное воздействие многих онкогенных белков, в том числе bcr/abl, заключается в усилении фосфорилизации Rb, из-за этого активность Rb ингибируется, и клетки могут постоянно делиться. На самом деле Rb отключается при многих, а возможно, и при всех видах рака у человека.
Здесь мы вновь сталкиваемся с определенной отрицательной регуляцией и уже знакомым нам регуляторным законом двойного отрицания. В приницпе, Rb тормозит деление клеток. Таким образом, рост клеток возможен лишь при ингибировании этого репрессора. Но при выключении (слева) или утрате (справа) гена Rb клетки могут постоянно де литься.
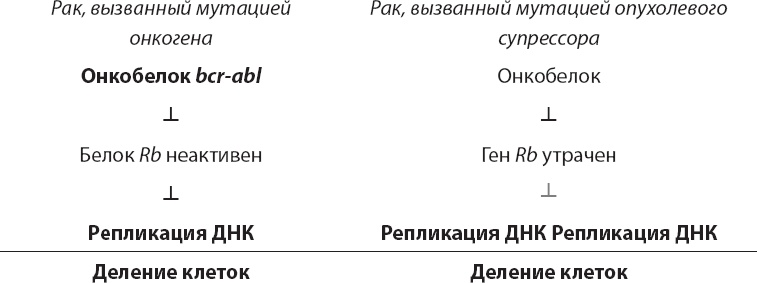
Роль Rb замечательно согласуется с размышлениями Моно и Жакоба, которые десятилетиями ранее полагали, что причиной рака может быть отключение репрессора деления клеток (см. главу 3).
Теперь, зная, как мутации определенных генов нарушают законы регуляции клеточного роста, мы сталкиваемся с вызовом: как (если это возможно) затормозить деление раковых клеток.
Логическая терапия и рациональные лекарства
Десятилетиями рак пытались лечить хирургически, облучением и смесями препаратов, убивающих делящиеся клетки. Химиотерапия является неизбирательным инструментом, она не нацелена на раковые клетки как таковые, поэтому эффективность химиотерапии не гарантирована, а еще такая терапия чревата многочисленными опасными побочными эффектами. Давняя надежда, связываемая с онкологическими исследованиями, – разработать более эффективные и безопасные варианты лечения, нацеленные против конкретного вида рака, которым страдает человек. Эта надежда уже становится реальностью. Один из первых препаратов этого нового класса называется иматиниб. Он борется с той самой мутацией, которую Джанет Роули заметила, разложив снимки перед собой на обеденном столе.
Как и многие первопроходцы, иматиниб несколько раз чуть не сгинул на пути к цели. Действительно, прослеживаются поразительные параллели между историей иматиниба и разработкой первого статина. Но вновь благодаря врачам, видевшим необходимость в препарате и неустанно стимулировавшим работу над ним, эти исследования завершились головокружительным клиническим успехом, изменившим историю медицины.
При транслокации bcr/abl возникает гиперактивная протеинкиназа, вызывающая отключение репрессора Rb, что в свою очередь приводит к неконтролируемому делению клеток. Требовалось лекарство, которое бы справилось с законом двойного отрицания ХМЛ, то есть ингибировало бы bcr/abl и не позволяло ферменту-предателю творить свое черное дело.
Ник Лайдон и Алекс Маттер, двое ученых из фармацевтической компании Ciba-Geigy, расположенной в швейцарском Базеле, определили, что, поскольку многие гены кодируют измененные киназы, ингибиторы ферментов могут блокировать рост раковых клеток. В отличие от Эндо, они не стали искать такое средство в природе, не стали действовать и принятым в фармакологической индустрии методом проб и ошибок, а воспользовались методом «рационального проектирования» и стали разрабатывать такие молекулы, которые входили бы в активный центр киназы, как ключ в замок, и блокировали его, закрывая доступ для настоящего «ключа». Потратив годы на химический синтез и опыты, они получили несколько перспективных соединений, в том числе и такую молекулу, которая ингибировала нормальную киназу c-abl.
Чтобы выяснить, будут ли какие-либо из этих соединений действовать на клетки ХМЛ, Лайдон показал их знакомому врачу. Этот врач, Брайан Дракер из Орегонского университета медицинских наук в Портленде, не только очень интересовался потенциальными ингибиторами киназы bcr/abl, но и (что очень важно) имел доступ к клеткам ХМЛ-пациентов. Дракер обнаружил, что одно из соединений, полученных от Лайдона, в очень низких концентрациях убивало лишь клетки ХМЛ, а обычные клетки не затрагивало.
Дракер, Лайдон и Маттер были воодушевлены результатами, однако фармкомпания полагала, что рыночные перспективы ХМЛ-специфичного препарата сомнительны. Ученым потребовалось более года, чтобы убедить руководство продолжить испытания на животных. Затем первые токсикологические опыты на собаках вызвали подозрение, что препарат небезопасен для людей при внутривенном введении. Вскоре после этого произошло слияние Ciba-Geigy с фармацевтической компанией Sandoz, и возникла новая компания Novartis. После слияния компаний разработка препарата приостановилась, и Лайдон уволился.
В конце концов ученые Novartis опробовали на животных пероральную форму лекарства, но результаты вновь получились противоречивыми. Один токсиколог сказал Маттеру: «Если вы собираетесь колоть это человеку, то только через мой труп».
Однако Дракер не отступил. Прогноз у его пациентов был суровый – от четверти до половины всех больных умирали в течение года после постановки диагноза, а те терапевтические возможности, которыми он располагал, позволяли по крайней мере выиграть время. Дракер полагал, что любые проблемы с токсичностью решаемы, если тщательно наблюдать пациентов и контролировать дозировку. Он уговорил Маттера «не губить лекарство». Маттер продолжал убеждать руководство в необходимости препарата. Наконец Даниэль Васелла, новый исполнительный директор Novartis, санкционировал клинические испытания на людях. Исследование началось в июне 1998 г., спустя почти пять лет после того, как Дракер впервые опробовал препарат на клетках ХМЛ в лаборатории.
Дракер и два других врача стали давать малые дозы препарата небольшой группе пациентов с ХМЛ, постепенно увеличивая дозировку и отслеживая как ход болезни, так и потенциальные побочные эффекты. Основным индикатором полезности было бы снижение количества лейкоцитов: как правило, в микролитре крови должно быть 4000–10 000 лейкоцитов, а у пациентов с ХМЛ этот показатель достигал 100 000–500 000 клеток. Низкие дозы не действовали. Затем, когда доза была увеличена, у некоторых пациентов уровень лейкоцитов снизился до нормального. Анализ крови показал, что также уменьшилась доля клеток с филадельфийской хромосомой. Препарат попадал в цель.
Novartis бросила все силы на разработку препарата. Испытания были расширены, дозы увеличены, а пациентов наблюдали в течение девяти месяцев. У 97 % пациентов, получавших максимальную дозу препарата, уровень лейкоцитов нормализовался, обычно на это требовалось от одного до полутора месяцев. Три четверти пациентов избавились от раковых клеток, содержавших филадельфийскую хромосому. Эти результаты были не просто хорошими, а грандиозными, беспрецедентными в истории химиотерапии. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) рассмотрело препарат вне очереди и менее чем через три месяца, в мае 2001 г., одобрило его.

