Как добиться такого результата? У Agrobacterium tumefaciens есть, помимо других генов, небольшая кольцевая ДНК, Ti-плазмида. В ней есть маленький участок под названием T-ДНК, который будет встраиваться в ДНК растения и заставлять клетки бурно делиться и синтезировать для бактерии еду. А еще в Ti-плазмиде закодировано несколько белков, которые нужны для того, чтобы между клеткой растения и клеткой бактерии образовался канал, а еще для того, чтобы протащить через него T-ДНК и сделать так, чтобы она попала в ядро растительной клетки и встроилась в хозяйскую ДНК. Сама бактерия остается снаружи, Ti-плазмида остается в бактерии, а в растение попадает только небольшой фрагмент ДНК. Потом, когда растительная клетка будет делиться, она будет передавать бактериальные гены и своим потомкам.
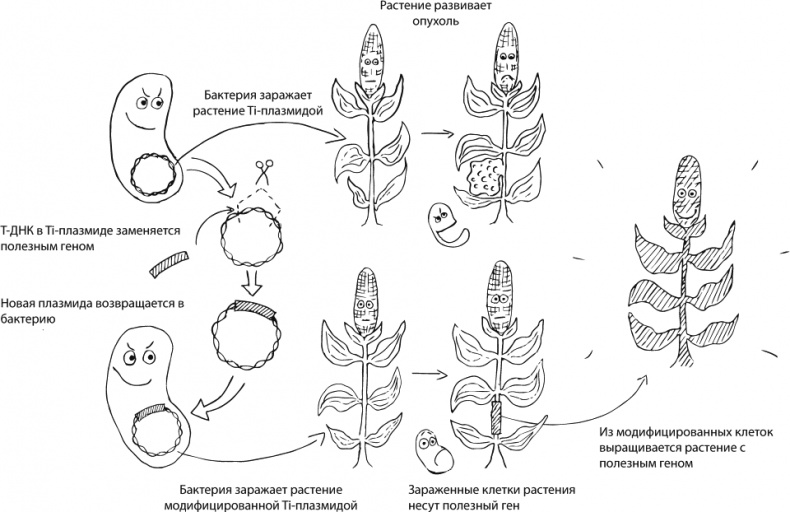
Генетики берут эту готовую конструкцию, выкидывают из нее все те гены, которые нужны бактерии, и вставляют те, которые нужны людям. Несчастная обманутая бактерия проделывает всю ту же самую работу, но модифицированная клетка растения уже не начинает бурно делиться и не производит опины – зато обладает теми свойствами, которые нужны нам. Потом из удачно модифицированной клетки, благодаря способности растений к вегетативному размножению, можно будет вырастить целый организм. Именно с помощью такого подхода получена, например, устойчивая к засухе кукуруза MON87460, которую интенсивно выращивают по обе стороны Атлантического океана. В нее был введен бактериальный ген cspB, отвечающий за производство РНК-шаперона – белка, предотвращающего неправильную укладку молекул РНК под действием стресса, в данном случае недостатка воды. Его присутствие помогает кукурузе выращивать нормальные семена, даже когда ее недостаточно поливают. По остальным экологическим и пищевым параметрам эта кукуруза не отличается от такой же, но немодифицированной [16], [17].
Главный недостаток агробактериальной трансформации (и других методик генной инженерии первого поколения) – это невозможность контролировать, в какое именно место в ДНК растения встроится новая конструкция. Вообще-то это не такая большая проблема: мы ведь получаем не единственное растение, а несколько. Если она где-то встроится так, чтобы это повлияло на остальные свойства растения, – исследователи это заметят. Если будут сомневаться – расшифруют ДНК, чтобы установить место локализации точно. Тем не менее, действительно, методы генной инженерии нового поколения направлены на то, чтобы встраивать новую ДНК не куда попало, а в заранее заданное место. Есть несколько способов делать это в пробирке, но главный писк моды сейчас – система CRISPR/Cas9, позволяющая вставлять гены в заданное место прямо в живой клетке. Эта методика может не только упростить и удешевить получение новых генетически модифицированных животных и растений, но и привести к серьезным прорывам в медицине. Я уже упоминала ее в связи с вырезанием из человеческих клеток ДНК вируса иммунодефицита человека. Другая перспективная сфера применения – генная терапия, исправление ДНК человека для излечения наследственных заболеваний. Конечно, исследования и клинические испытания в этой области проводились и до появления CRISPR/Cas9, в том числе вполне успешные, но она вполне может в обозримом будущем привести к переходу медицины на качественно новый уровень. И да, систему CRISPR/ Cas9 исследователи тоже позаимствовали у бактерий. Зачем она им? Не поверите, это их приобретенный иммунитет.
Мы все знаем со школьной скамьи, что приобретенные признаки не наследуются. Это, в общем, правильный принцип. Он остается верным и в том случае, если обретение нового признака привело к изменению генов – но не во всем организме, а в каких-то отдельных его клетках, не участвующих в размножении. Если вы переболели краснухой и у вас сформировался к ней иммунитет, то геном тех B-лимфоцитов, которые с ней боролись, изменился, пока они подстраивались под выработку оптимальных антител против данного вируса. Но у вашего ребенка все равно не будет иммунитета к краснухе, если только не пытаться клонировать его из соответствующей клетки иммунной памяти (честное слово, это плохая идея). Если почвенная агробактерия изменила клетки корня растения, чтобы они бурно размножались и вырабатывали опсины, потомки этого растения, выращенные из семян, все равно не будут этого делать: где корень, а где семена?
Но вот если генетически изменилась та самая клетка, из которой получится потомство, – это совсем другое дело. Приобретенные признаки наследуются, когда генные инженеры используют способность растений к вегетативному размножению и выращивают целый организм из модифицированной ими клетки корня. А в природе приобретенные признаки сплошь и рядом наследуются у одноклеточных существ. Все, что повлияло на геном бактерии, передается ее потомкам. Благодаря этому она может позволить себе завести самый настоящий приобретенный иммунитет, что едва ли имело бы смысл без его передачи по наследству (много ли вирусов успеет встретить бактерия за 20 минут своей жизни от деления до деления?).
Когда бактерия все-таки встречается с атакующим ее вирусом, она берет из его ДНК кусочек и встраивает в свой собственный геном – на память. Не куда попало, а между определенными генетическими последовательностями, которые называются CRISPR.
Затем этот кусочек ДНК вируса используется как фоторобот. Бактерия строит по нему РНК-зонд, который плавает по ее клетке и ищет другие такие же фрагменты вирусной ДНК. Как только находит – в дело вступает белок-ножницы Cas9, разрезающий нежелательную ДНК и таким образом блокирующий дальнейшее размножение вирусов.
Что означало открытие этой системы для генных инженеров? Счастье, радость и торжество. У них появился комплекс из РНК-зонда и белка Cas9, способный узнавать конкретные нуклеотидные последовательности, и разрезать их в определенной точке, и делать это прямо в живой клетке. Что будет, если такую систему запустить в клетку высшего организма, настроив на распознавание его генов? Сам комплекс CRISPR/Cas9 просто разрежет обе цепи ДНК, и всё. Казалось бы, ничего хорошего.
Но дальше в игру вступают наши собственные механизмы починки генов. Чтобы правильно залатать разрез, они будут сравнивать испорченную ДНК с таким же участком на второй хромосоме (мы получаем хромосомы с одними и теми же генами от папы и от мамы). Если мы разрезали плохую, мутантную версию гена, а на второй хромосоме все в порядке – получается, что клетка сама починит ген, воспользовавшись образцом. Если нам нужно что-то новое – можно подсунуть клетке дополнительный фрагмент ДНК, который она сможет принять за вторую хромосому и использовать как образец.
Это еще не предел возможного. Систему можно настроить таким образом, чтобы клетка не просто починила себе одну хромосому, но и потом использовала ее как образец для починки второй. Исследователи, описавшие этот феномен, назвали его “мутагенная цепная реакция” [18]. Правда, они скорее ломали гены, чем чинили, – в экспериментальных целях, для наглядности.
У дрозофил есть ген yellow. Он так называется потому, что при его мутациях мушка перестает вырабатывать пигмент меланин и становится желтой. Он находится на X-хромосоме, а определение пола у мух такое же, как у нас. То есть классические законы наследования предполагают, что если скрестить желтых мух с обычными, коричнево-полосатыми, то все дочери в первом поколении будут коричнево-полосатыми, потому что по крайней мере от одного из родителей они получат нормальную Х-хромосому.



